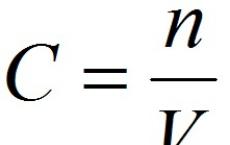Kako pronaći koncentraciju supstance u fizici. Koncentracija rastvora
Može se izraziti i u bezdimenzionalnim jedinicama (frakcije, procenti) i u dimenzionalnim količinama (maseni udjeli, molarnost, titri, molni udjeli).
Koncentracija- ovo je kvantitativni sastav rastvorene supstance (u određenim jedinicama) po jedinici zapremine ili mase. Označite otopljenu supstancu - X, i rastvarač - S. Najčešće koristim koncept molarnosti (molarne koncentracije) i molne frakcije.
1. (ili postotak koncentracije tvari) je omjer mase otopljene tvari m na ukupnu masu rastvora. Za binarno rješenje koje se sastoji od otopljene tvari i otapala:
ω - maseni udio rastvorene supstance;
m in-va- masa rastvorene supstance;
mrješenje- masa rastvarača.
Maseni udio se izražava u udjelima jedinice ili u postocima.
2. Molarna koncentracija ili molarnost je broj molova otopljene tvari u jednoj litri otopine V:
 ,
,
C- molarna koncentracija otopljene supstance, mol/l (moguća je i oznaka M, Na primjer, 0,2 MHCl);
n
V- zapremina rastvora, l.
Rješenje se zove molar ili unimolar, ako je 1 mol supstance otopljen u 1 litru rastvora, decimolar- 0,1 mol supstance je otopljen, centimolar- 0,01 mol supstance je otopljen, milimolarni- Otopljeno je 0,001 mol supstance.
3. Molalna koncentracija(molalnost) rastvora C(x) pokazuje broj mladeža n rastvorene supstance u 1 kg rastvarača m:
 ,
,
C(x)- molalitet, mol/kg;
n- količina rastvorene supstance, mol;
mr-la- masa rastvarača, kg.
4. - sadržaj supstance u gramima u 1 ml rastvora:
 ,
,
T- titar rastvorene supstance, g/ml;
m in-va- masa rastvorene supstance, g;
V rješenje- zapremina rastvora, ml.
5. - bezdimenzionalna količina jednaka odnosu količine rastvorene supstance n na ukupnu količinu tvari u otopini:
 ,
,
N- molni udio rastvorene supstance;
n- količina rastvorene supstance, mol;
n r-la- količina rastvarača, mol.
Zbir molnih frakcija mora biti jednak 1:
N(X) + N(S) = 1.
Gdje N(X) X;
N(S) - molni udio otopljene tvari S.
Ponekad je prilikom rješavanja problema potrebno prijeći s jedne jedinice izražavanja na drugu:

ω(X) - maseni udio rastvorene supstance, u %;
M(X)- molarna masa rastvorene supstance;
ρ = m/(1000 V) je gustina rastvora.6. - broj gram ekvivalenata date supstance u jednom litru rastvora.
Gramski ekvivalent supstance- broj grama supstance, brojčano jednak njenom ekvivalentu.
Ekvivalentno je konvencionalna jedinica ekvivalentna jednom ionu vodika u kiselo-baznim reakcijama ili jednom elektronu u redoks reakcijama.
Za bilježenje koncentracije takvih otopina koriste se skraćenice n ili N. Na primjer, otopina koja sadrži 0,1 mol-eq/l naziva se decinormalna i piše se kao 0,1 n.
 ,
,
C N- normalna koncentracija, mol-ekviv/l;
z- ekvivalentni broj;
V rješenje- zapremina rastvora, l.
Rastvorljivost tvar S - najveća masa tvari koja se može otopiti u 100 g rastvarača:

Koeficijent rastvorljivosti- omjer mase tvari koja formira zasićenu otopinu na određenoj temperaturi prema masi rastvarača:

0 - prosječna apsolutna temperatura ekrana u °K; Cs - konstanta zračenja crnog tijela
Cs = 4,88 - konstanta zračenja crnog tijela.
V,. = 639 + 273 = 906 °K C3 = 4,88 - konstanta zračenja crnog tijela.
gdje je C s konstanta zračenja crnog tijela, Cs = 5,67 W/; Hs - ekvivalentna apsolutno crna površina, m2; Tp - temperatura produkata sagorevanja na prolazu, K; 9 - prosječna temperatura površine
gdje je Yar.Tr površina zračećih cijevi, m2; Gmax - maksimalna temperatura sagorevanja, K; Go - prosječna temperatura ekrana, K; s$ je konstanta zračenja crnog tijela; cg = 5,67 W/.
gdje je Cs konstanta zračenja apsolutno crnog tijela, jednaka 5,67 W/; Hs - ekvivalentna apsolutno crna površina, m2; Tp - temperatura gasova koji izlaze iz peći, K; 0 - prosječna temperatura vanjske površine zračnih cijevi, K.
gdje su dr i drk toplinski intenzitet zračećih cijevi, ukupan i koji se može pripisati slobodnoj konvekciji, W/m2; NR/N5 - odnos površine zračećih cevi Nr prema ekvivalentnoj apsolutno crnoj površini Hs, u zavisnosti od vrste peći i načina sagorevanja goriva; 9 - prosječna temperatura vanjskog zida zračećih cijevi, K; \)))/ - koeficijent u zavisnosti od raspodele temperature u peći, vrste peći i vrste goriva; Cs je konstanta zračenja potpuno crnog tijela, jednaka 5,67 W/.
gdje je cs konstanta zračenja crnog tijela, jednaka
C = 5,67 W/=20,77 kJ/-konstanta zračenja crnog tijela.
gde su ca i cn zapreminski toplotni kapaciteti dimnih gasova pri temperaturi sagorevanja goriva Ta i temperaturi dimnih gasova na prolazu Gp, kJ/; at - stepen crnila ložišta; st - konstanta zračenja peći, W/.
gdje je c" konstanta zračenja, kcal/; d je prečnik zrna, m.
Završetak sagorijevanja površinskog koksa određen je temperaturom u reaktorima i sadržajem kisika u dimnim plinovima nakon reaktora. Konstantna koncentracija kiseonika na ulazu i izlazu iz reaktora ukazuje na kraj sagorevanja. Posljednji period regeneracije, povezan s povećanjem temperature plina na izlazu iz peći, neophodan je za sagorijevanje dubokog, teško oksidirajućeg koksa. Nakon završetka perioda sagorevanja površinskog koksa, prelazi se na kalcinaciju katalizatora, koje se dešava na višoj temperaturi na izlazu iz peći, pa prema projektnim uslovima pritisak tokom kalcinacije opada ili ostaje na isti nivo.
Ion dušika se uklanja iz reaktivnih aromatičnih spojeva gotovo istom brzinom kojom se formira. Stoga je opažena brzina reakcije k", ista je za sva aromatična jedinjenja dovoljne aktivnosti. Za manje reaktivna aromatična jedinjenja, reakcija može biti reverzibilna, tako da se uspostavlja konstantna koncentracija nitronijum jona. Ukupna brzina će tada ovise o koncentraciji i strukturi aromatičnog spoja.
1. Kontinuirano snabdijevanje svježom kiselinom i kontinuirano uklanjanje istrošene kiseline. U ovom slučaju, sistem održava konstantnu koncentraciju kiseline od oko 88%.
Sa mehanizmom intradifuzije, ostatak koksa se akumulira samo u centru čestice katalizatora. Količina nastalog koksa se smanjuje iz ciklusa u ciklus, ali količina sagorjelog koksa ostaje nepromijenjena. Konstantna koncentracija zaostalog koksa se uspostavlja kada se postigne maksimalna koncentracija koksa u centru čestice.
uvedene čestice kroz cijeli volumen reakcione smjese koja ispunjava reaktor, te konstantna koncentracija reaktanata u svakoj fazi.
Obično se održava konstantna koncentracija od 30%.
Konstantna koncentracija pinena na katalitičkoj površini je
Konstantna koncentracija pinena na površini katalizatora može nastati samo ako je adsorpcija pinena površinom katalizatora višestruko veća od adsorpcije produkta reakcije, koji se, kako se formiraju, odmah istiskuju s površine i postoji dovoljno dobar prijenos mase u sistemu da osigura neophodan priliv pinena na površinski katalizator.
Esterifikacija pentazola octenom kiselinom vrši se periodično u bakrenom horizontalnom kotlu opremljenom kolonom sa bakrenim pločama. Reakcija se odvija između amil alkohola i 40% sirćetne kiseline u prisustvu koncentrovane sumporne kiseline i zagrijana do ključanja. Sirćetna kiselina se unosi postepeno, tako da se stalno održava konstantna koncentracija od 4%. Destilacija se vrši uz navodnjavanje; proizvod se sakuplja u separatoru vode. Reakcija se izvodi sve dok se alkoholi koji su uvedeni u proces potpuno ne odstrane.
U kontinuiranom procesu, tereftalna kiselina se taloži tokom oksidacije zbog prisustva velike količine koncentrirane sirćetne kiseline u smjesi. Mešavina sadrži 48,5 delova l-ksilena, 125 delova glacijalne sirćetne kiseline, 0,6 delova mangan acetata i 0,5 delova amonijum bromida. U ovom slučaju konverzija je nešto veća, ali ako se ne održava konstantna koncentracija octene kiseline, prinos ne prelazi 75%.
Način uvođenja pufera u pražnjenje ovisi o ulozi koju obavlja. Ako je pufer namijenjen samo za stabilizaciju temperature plazme, onda se može uvesti u zonu pražnjenja na bilo koji pogodan način.U tom slučaju se postavlja jedan osnovni zahtjev: konstantna koncentracija puferskih elemenata u oblaku pražnjenja.
Mentalna koncentracija se može definirati kao sposobnost fokusiranja naše pažnje na jednu stvar isključujući sve ostalo. Obično se možemo fokusirati samo na one stvari koje nas zaista zanimaju, ali nam je teško stalno obraćati pažnju na stvari koje nas posebno ne zanimaju.
Suprotno uvriježenom mišljenju, intenzivna koncentracija na određeni zadatak ne uzrokuje veći utrošak energije, naprotiv, smanjuje se. U praksi, kada čovjek pokušava da uštedi energiju, on svoj posao obavlja bez želje, misleći da mu manji napor omogućava da troši manje energije. Međutim, osoba ne shvaća da nedostatak entuzijazma dovodi do koegzistencije dvije suprotstavljene pozicije: unutrašnje nevoljkosti za rad i vitalne potrebe da se to radi.
Nervna napetost je uvijek rezultat djelovanja suprotstavljenih sila, što dovodi do psihofizičkog rascjepa osobe. U nedostatku dualnosti, osoba ima bolju kontrolu nad sobom i izbjegava trošenje energije, što je neizbježno kada se fokusira na više objekata istovremeno. Znamo da anksioznost značajno iscrpljuje odbrambene mehanizme organizma, stvara nervnu tenziju i dovodi do toga da osoba „radi do kraja“. Sve na šta usmjerimo pažnju počinje nam u većoj ili manjoj mjeri „smetati“. Ako je naša pažnja usmjerena na više stvari odjednom, kao u priči o Charlesu M., datoj u poglavlju “Stvarno postojanje i fantazijski život”, to uvelike povećava stepen anksioznosti. Mnoge naše percepcije, čak i one podsvjesne, stvaraju nam problem, odnosno poticaj za odluku, zaključak ili određeno psihičko stanje. Na primjer, incident viđen na ulici koji nas se direktno ne tiče izaziva intenzivan rad podsvijesti u našem mozgu kao odgovor na nesvjesnu anksioznost.
Zamislimo da, pregledavajući novine, naiđemo na alarmantan naslov i nejasno smo svjesni da to znači ratnu prijetnju u određenoj tački na planeti. Može se dogoditi da naša podsvijest, uplašena takvom perspektivom, odmah počne smišljati kako da osigura svoju sigurnost u takvom slučaju. Nesvjesnoj mašti ovo će ostati neriješen problem koji će se na ovaj ili onaj način morati riješiti i vjerovatno će nas još dugo mučiti, pogotovo ako do nas stignu druge slične vijesti. Ovo je samo jedna od mnogih percepcija koje imamo tokom dana. Tome treba dodati i sve one koje su pohranjene u našem pamćenju i koje lako izbijaju na površinu svijesti ako nemamo određenu sposobnost mentalne koncentracije.
Što više stvari osoba mora uključiti u polje svoje pažnje u datom trenutku, to njeno „ja“ postaje sve fragmentiranije. Iz tog razloga postaje nemoguće postići visok nivo svijesti, koji karakterizira prisustvo nedjeljivog, integralnog i zrelog “ja”.
Postoji mnogo stupnjeva mentalne koncentracije koji odgovaraju intenzitetu pažnje. Ostavljajući po strani ovu gradaciju, razlikovat ćemo dvije glavne vrste mentalne koncentracije: intenzivnu koncentraciju i smirenu koncentraciju. Svaki od njih može biti dobrovoljan ili nedobrovoljan. Koncentracija je dobrovoljna, kada postoji namjerna želja da se pažnja usmjeri na jednu stvar, a sve ostalo isključi, i nevoljna, kada je um zarobljen nekim stimulusom. Razmotrićemo samo proizvoljnu koncentraciju.
Voljna koncentracija je intenzivna kada je praćena mišićnim naporom koji ima za cilj da fiksira i učini živopisnijom mentalnu sliku, apstraktnu ili konkretnu. Često, kada se pokušavaju koncentrirati na nešto, ljudi napnu mišiće lica, na primjer, mršteći se, stežući čeljusti, što samo po sebi izaziva stanje nervne napetosti.
Hajde da se zadržimo na jednoj izuzetno zanimljivoj činjenici koja je direktno povezana sa temom o kojoj se ovde govori. Riječ je o nekim posljedicama stanja napetosti kojih se još nismo dotakli.
Prethodno smo napetost smatrali patologijom, odnosno „prekomernom napetošću“ i analizirali štetu koju ona može nanijeti ljudskom tijelu. Ipak, kao što je već spomenuto u prvom poglavlju, stanje napetosti je prirodno i neophodno za aktivan život. Tenzija postaje štetna samo kada je prevelika. Ako govorimo o inteligenciji, onda je glavni problem ljudi upravo suprotan fenomenu nervne napetosti. U ovom slučaju dolazi do “patološke atonije”. Definišimo mentalnu koncentraciju kao napetost mašte, a odsutnost kao atoniju mašte. Napetost „čiste” mašte ne treba mešati sa stanjem emocionalnog nemira, koje izaziva anksiozne misli koje dovode do preterane napetosti. U ovom slučaju dolazi do nevoljne koncentracije, bez sudjelovanja "ja". Svesna koncentracija je uvek namerno delovanje Jastva.
Intelektualna atonija ili atonija "ja" je nedostatak svjesnog razmišljanja i prevlast podsvjesne aktivnosti.
Glavni cilj hipsosvesti, kao što smo već rekli, a o čemu svedoči i sam naziv, jeste postizanje višeg nivoa svesti. Možete povećati svijest jačanjem i postizanjem pune zrelosti "ja". Koncentracija značajno povećava mentalni tonus osobe i omogućava mu da u potpunosti iskoristi svoju volju i kreativno razmišljanje.
U svojoj knjizi “Mentalni ton” Jean-Claude Fillou piše sljedeće: “Volja, hrabrost, upornost, samokontrola i sposobnost da ostanete smireni u teškim trenucima znače stanja u kojima cjelokupna energija osobe ima posebno visok ton. . Nasuprot tome, ljudi koji su pasivni, inertni i lako uzbuljivi imaju vrlo nizak ton, jer uzalud troše snagu. Tu spadaju i asteničari svih tipova, ljudi koji su nestrpljivi, neodlučni i bespomoćni – jednom riječju, oni kojima je suđeno da budu igračka vanjskih sila, umjesto da se aktivnom, svjesnom adaptacijom na vanjski svijet uspostavljaju i ostavljaju trag. na tome.” “Uporna osoba, na primjer, ima visoku vitalnost jer zna kako da iskoristi svoju snagu. Nestabilna i impulsivna osoba ima nedovoljan ton, jer neispravno koristi svoje moći i loše upravlja njima.”
Mogli bismo reći da nedostatak mentalnog tonusa znači "slabost svijesti" zbog niskog nivoa "buđenja" i, naravno, pogrešnog treninga koji prati nizak nivo svijesti.
Što se tiče odnosa koncentracije i utroška energije, obično se tvrdi da, budući da koncentracija zahtijeva mnogo truda, njen visoki nivo ne može pomoći u smanjenju potrošnje energije. U stvari, tiha koncentracija ne zahtijeva mnogo truda i predstavlja sposobnost mirnog držanja mentalne slike. Naprotiv, koncentracija, koja je praćena značajnim nervnim naporom, nesumnjivo dovodi do velikog trošenja energije, posebno kada je nevoljna i uzrokovana iznenadnim i snažnim emocionalnim impulsom.
Govoreći o koncentraciji, treba razmotriti i problem nemogućnosti osobe da oslobodi svoj um od određenih misli, emocija, iskustava ili senzacija iz daleke ili bliske prošlosti. Na primjer, svaki kompleks je nesposobnost da se oslobodimo emocionalnog šoka prošlosti, koju osoba smatra dijelom sadašnjosti.
Možemo reći da koncentracija ne uzrokuje umor, već predstavlja mentalni tonus koji bi trebao biti normalan za čovjeka. Lutanje uma je hipotonija misli, ne potiče odmor niti smanjuje potrošnju energije, već uzrokuje pad energije. Lutanje mašte ne doprinosi ostatku uma, već, naprotiv, povećava broj podražaja u ljudskom umu, od kojih svaki stvara još jedan problem koji zahtijeva vlastito rješenje.
Jedini zaista efikasan odmor za um dolazi iz stanja koje se može postići učenjem potpunog oslobađanja uma od misli, odnosno stanja „mentalnog vakuuma“ kada tok misli privremeno prestane. Ovo stanje se može definirati kao potpuna "dekoncentracija". Tehnika postizanja mentalne koncentracije uvijek ovisi o tome da li je postignut poseban emocionalni i voljni položaj u kojem osoba pridaje isključivi, isključivi značaj aktivnosti, predmeta ili ideje na koju se želi koncentrirati. Ovo je stanje potpune ravnodušnosti osobe prema svemu što nije predmet njegovog interesa. Ključni faktor u tehnici koncentracije je ravnodušnost prema drugim stimulansima i idejama, zasnovana na voljnom naporu. Moramo spomenuti i još jedan vrlo važan faktor: kada se čovjek pravilno koncentriše, on živi u sadašnjosti (vidi poglavlje „Istinsko i imaginarno postojanje“).
Da bismo pravilno procijenili mehanizam koncentracije, navedimo jedan primjer: čovjeku je mnogo lakše da se koncentriše ako to mora učiniti, kada postoji jaka vanjska prisila koja ga prisiljava da završi posao ili riješi neki problem u određenom vremenu. okvir. Proces koncentracije će biti još lakši ako se suoči sa kaznom zbog neizvršavanja zadatka na vrijeme.
Kada osoba želi da se fokusira na nešto, mora dati najveću važnost onome na šta će usmjeriti svoju pažnju. Mora misliti da mu je veoma važno da posveti isključivu pažnju temi koja ga zanima i da je to „pitanje života ili smrti“. Sljedeća stvar koju treba zapamtiti je pravilna upotreba disanja. Neophodno je duboko udahnuti da bi se snagom volje postigla koncentracija cijele svoje psihofizičke strukture. Da biste održali koncentraciju, morate fiksirati pažnju, što se može postići višim stepenom buđenja. Stanje koncentracije zapravo predstavlja viši stepen budnosti uma. Suprotno tome, nemogućnost koncentracije je uvijek uzrokovana spavanjem uma, odnosno niskim nivoom svijesti. Da biste se efikasno koncentrirali, morate izbjegavati dosadu i mentalni san i svaku ideju, zadatak ili predmet doživljavati kao da se susrećete prvi put u životu.
Enciklopedijski YouTube
1 / 5
✪ Zadaci koncentracije
✪ Normalna koncentracija rastvora. Normalnost (SN). Rješavanje problema.
✪ Koncentracija. Kospalar
✪ Zadatak 22 Zadatak koncentracije
✪ Hemija. Koncentracija supstance. Foxford Online Learning Center
Titlovi
Maseni udio
Maseni udio komponente je omjer mase date komponente prema zbroju masa svih komponenti. Prema preporukama IUPAC-a, to je označeno simbolom w (\displaystyle w), u literaturi na ruskom jeziku oznaka je češća ω (\displaystyle \omega ). Maseni udio je bezdimenzionalna veličina, obično izražena u dijelovima jedinice ili u postocima (da biste izrazili maseni udio u postocima, pomnožite navedeni izraz sa 100%):
ω B = m B m (\displaystyle \omega _(\mathrm (B) )=(\frac (m_(\mathrm (B) ))(m)))U binarnim otopinama često postoji nedvosmislena (funkcionalna) veza između gustine otopine i njene koncentracije (na datoj temperaturi). To omogućava da se u praksi određuju koncentracije važnih otopina pomoću denzimetra (alkoholomjer, saharimetar, laktometar). Neki hidrometri se kalibriraju ne u vrijednostima gustoće, već direktno u koncentraciji otopine (alkohol, mast u mlijeku, šećer). Treba uzeti u obzir da za neke supstance krivulja gustine rastvora ima maksimum; u ovom slučaju se provode dva merenja: direktno i uz blago razblaživanje rastvora.
Često se za izražavanje koncentracije (na primjer, sumporne kiseline u elektrolitu punjivih baterija) jednostavno koristi njihova gustoća. Uobičajeni su hidrometri (denzimetri, denzitometri) dizajnirani za određivanje koncentracije otopina tvari.
Zapreminski udio
Zapreminski udio komponente je omjer volumena komponente i zbira zapremina komponenti prije miješanja. Zapreminski udio se mjeri u udjelima jedinice ili kao postotak.
ϕ B = V B ∑ V i (\displaystyle \phi _(\mathrm (B) )=(\frac (V_(\mathrm (B) ))(\sum V_(i)))),Prilikom miješanja tekućina njihov ukupni volumen može se smanjiti, tako da ne biste trebali zamijeniti zbir volumena komponenti zapreminom smjese.
Kao što je gore spomenuto, postoje hidrometri dizajnirani za određivanje koncentracije otopina određenih tvari. Takvi hidrometri se kalibriraju ne u vrijednostima gustoće, već direktno u koncentraciji otopine. Za uobičajene otopine etilnog alkohola, čija se koncentracija obično izražava kao volumenski postotak, takvi hidrometri se nazivaju alkoholometri ili andrometri.
Molarnost (molarna volumna koncentracija)
Molarna koncentracija (molarnost, molarnost) - količina supstance (broj molova) komponente po jedinici zapremine smeše. Molarna koncentracija u SI sistemu mjeri se u mol/m³, ali se u praksi mnogo češće izražava u mol/l ili mmol/l. Također se koristi izraz „u molarnosti“. Moguća je još jedna oznaka za molarnu koncentraciju, koja se obično označava kao M. Tako se otopina s koncentracijom od 0,5 mol/l naziva 0,5 molar, napisano “0,5 M”.
Napomena: Iza broja pišu „mol“, kao što iza broja pišu „cm“, „kg“ itd., bez smanjenja po padežima.
c B = n B V (\displaystyle (c_(\mathrm (B) ))=(\frac (n_(\mathrm (B) ))(V))),Normalna koncentracija (molarni koncentracijski ekvivalent, « normalnost»)
Normalna koncentracija je broj ekvivalenata date supstance u 1 litru smjese. Normalna koncentracija se izražava u mol-eq/l ili g-eq/l (što znači molski ekvivalent). Za evidentiranje koncentracije takvih otopina koriste se skraćenice “ n" ili " N" Na primjer, otopina koja sadrži 0,1 mol-eq/l naziva se decinormalna i piše se kao 0,1 n.
c (f e q B) = c ((1 / z) B) = z ⋅ c B = z ⋅ n B V = 1 f e q ⋅ n B V (\displaystyle c(f_(eq)~\mathrm (B))=c( \big ()(1/z)~\mathrm (B) (\big))=z\cdot c_(\mathrm (B) )=z\cdot (\frac (n_(\mathrm (B) ))( V))=(\frac (1)(f_(eq)))\cdot (\frac (n_(\mathrm (B) ))(V))),Normalna koncentracija može varirati ovisno o reakciji u koju je supstanca uključena. Na primjer, jednomolarna otopina H 2 SO 4 će biti jednonormalna ako treba da reaguje sa alkalijom da bi se formirala kalijum hidrogen sulfat KHSO 4 , a dvonormalna u reakciji da bi se formirala K 2 SO 4 .
Molnaya (molar) dijeliti
Molni udio je omjer broja molova date komponente i ukupnog broja molova svih komponenti. Molni udio se izražava u udjelima jedinice. IUPAC preporučuje označavanje molskog udjela slovom x (\displaystyle x)(a za gasove - y (\displaystyle y)), također u literaturi postoje oznake χ (\displaystyle \chi ), X (\displaystyle X).
x B = n B ∑ n i (\displaystyle x_(\mathrm (B) )=(\frac (n_(\mathrm (B) ))(\sum n_(i)))),Molna frakcija se može koristiti, na primjer, za kvantificiranje nivoa zagađivača u zraku, i često se izražava u dijelovima na milion (ppm). Međutim, kao iu slučaju drugih bezdimenzijskih veličina, kako bi se izbjegla zabuna, treba navesti količinu na koju se navedena vrijednost odnosi.
Molalitet (molarna težinska koncentracija, molalnu koncentraciju)
Molalna koncentracija (molalitet, molarna težinska koncentracija) - količina otopljene tvari (broj molova) u 1000 g rastvarača. Izmjereno u molovima po kg, izraz "molalnost" je također uobičajen. Dakle, rješenje s koncentracijom 0,5 mol/kg pozvao 0,5 molar.
m B = n B m A (\displaystyle (m_(\mathrm (B) ))=(\frac (n_(\mathrm (B) ))(m_(\mathrm (A) )))),Posebnu pažnju treba obratiti na činjenicu da su, uprkos sličnosti naziva, molarna koncentracija i molalnost različite veličine. Prije svega, za razliku od molarne koncentracije, kada se koncentracija izražava molalitetom, proračun se temelji na masi rastvarač, a ne po zapremini rastvora. Molalnost, za razliku od molarne koncentracije, ne zavisi od temperature.
Masena koncentracija (titar)
Masena koncentracija je omjer mase otopljene tvari i volumena otopine. Prema preporukama IUPAC-a, to je označeno simbolom γ (\displaystyle \gamma ) ili ρ (\displaystyle \rho ) .
ρ B = m B V (\displaystyle \rho _(\mathrm (B) )=(\frac (m_(\mathrm (B) ))(V))).Formule za prijelaz iz jednog izraza koncentracije u drugi
U zavisnosti od izabrane formule, greška konverzije se kreće od nule do nekog decimalnog mesta.
Od masenog udjela do molarnosti
c B = ρ ⋅ ω B M (B) (\displaystyle c_(\mathrm (B) )=(\frac (\rho \cdot \omega _(\mathrm (B) ))(M(\mathrm (B)) ))),Ako je gustina rastvora izražena u g/ml, a molarna masa u g/mol, onda da bi se izrazio odgovor u mol/L izraz se mora pomnožiti sa 1000 ml/L. Ako je maseni udio izražen kao postotak, onda izraz treba podijeliti i sa 100%.