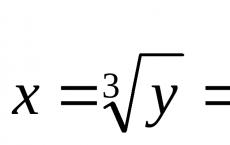Kemijske tvari. Što je tvar? Koje su klase tvari
po svom je značenju blizak pojmu materije, ali mu nije potpuno ekvivalentan. Dok se riječ "materija" uglavnom veže uz ideje o gruboj, inertnoj, mrtvoj stvarnosti, u kojoj dominiraju isključivo mehanički zakoni, supstanca je "materijal", koji zbog primanja oblika budi razmišljanja o obliku, životu. prikladnost, oplemenjenost. Vidi Gestalt tkanje.
Sjajna definicija
Nepotpuna definicija ↓
Supstanca
prema vrsti materije. Skup diskretnih formacija s masom mirovanja.
Opis "pogled" je morfološki, ispravan, ali nas ne može zadovoljiti, jer je riječ o čisto klasifikatorskoj podjeli, kojoj u stvarnosti, u prvoj aproksimaciji, ništa ne odgovara.
Postoji hipoteza da je materija u svom "čistom obliku" vakuum (prvi objekt). Zatim: supstancija je jedan od objekata (peti objekt) materijalnog svijeta; tvar u obliku stojnog vala tvori elementarna čestica (elektron, pozitron, proton, neutron itd.) - četvrti objekt, u obliku putujućeg vala - foton (treći objekt), i njihova kombinacija atom - tvar. Drugi objekt je polje (vakuumsko naprezanje, slično mehaničkom naprezanju opruge).
Ovdje možete sanjati: postoji vakuum (prvi objekt) i nešto drugo (nulti objekt), na primjer, apeiron, Univerzalni um, Bog itd., odnosno nešto što je izvan percepcije našeg Svijeta i čija interakcija s vakuumom daje polje i materiju čijim daljnjim razvojem (kretanjem i transformacijom) nastaje cjelokupna raznolikost Svijeta, uključujući i Život. Ova fantazija donekle proturječi sustavu pogleda na svijet koji se temelji na konceptu materije, kao stvari "dostupne našem promatranju".
Druga opcija: materija, polje i vakuum različita su agregatna stanja (slično kao što voda može biti u različitim agregatnim stanjima: plin, tekućina, krutina).
Vakuum je neporemećeno stanje, polje je napregnuto stanje, materija je oscilirajuće stanje. Razvijajući ideju dalje, dobivamo: nepomična materija - vakuum, naponski val koji se kreće u njoj - polje, foton, pokretni paket stojnih valova - tvar.
Nepotpuna definicija ↓
Pojam materije proučava nekoliko znanosti odjednom. Analizirat ćemo pitanje što su tvari s dvije točke gledišta - s pozicije kemijske znanosti i s pozicije fizike.
Supstanca u kemiji i fizici
Kemičari shvaćaju materiju kao fizikalnu tvar s određenim skupom kemijskih elemenata. U modernoj fizici materija se smatra vrstom materije koja se sastoji od fermiona ili vrstom materije koja sadrži fermione, bozone i ima masu mirovanja. Kao i obično, materija bi trebala biti sastavljena od čestica, uglavnom elektrona, protona i neutrona. Protoni i neutroni tvore atomske jezgre, a zajedno ti elementi tvore atome (atomsku tvar).
Svojstva materije
Gotovo svaka tvar ima svoj jedinstveni skup svojstava. Svojstva se shvaćaju kao karakteristike koje ukazuju na individualnost tvari, što pak pokazuje njezinu različitost od svih drugih tvari. Karakteristična fizikalno-kemijska svojstva su konstante - gustoća, Različite vrste temperature, termodinamika, pokazatelji kristalne strukture.
Kemijska klasifikacija tvari
U kemiji se tvari dijele na spojeve i njihove smjese. Osim toga, organske tvari treba reći.Spoj je skup atoma koji su međusobno povezani, uzimajući u obzir određene obrasce. Treba napomenuti da je granicu između spoja i smjese tvari prilično teško jasno definirati. To je zbog činjenice da znanost poznaje tvari promjenjivog sastava. Za njih je nemoguće napraviti točnu formulu. Osim toga, spoj je uglavnom apstrakcija, budući da se u praktičnom smislu može postići samo konačna čistoća tvari koja se proučava. Svaki postojeći u stvaran život uzorak je smjesa tvari, ali u kojoj prevladava jedna tvar iz cijele skupine. Osim toga, treba reći što su organske tvari. Ova skupina složenih tvari sadrži ugljik (proteini, ugljikohidrati).
Jednostavne i složene tvari
Jednostavne tvari (O2, O3, H2, Cl2) su one tvari koje se sastoje samo od atoma jednog kemijskog elementa. Ove tvari su oblik postojanja elemenata u slobodnom obliku. Drugim riječima, ove kemijski elementi, koji nisu povezani s drugim elementima, tvore jednostavne tvari. Znanosti je poznato više od 400 vrsta takvih tvari. Jednostavne tvari klasificiraju se prema vrsti veze između atoma. Dakle, jednostavne tvari dijelimo na metale (Na, Mg, Al, Bi itd.) i nemetale (H 2, N 2, Br 2, Si itd.).
Spojevi su kemijski spojevi koji se sastoje od dva ili više elemenata međusobno povezanih. Jednostavne tvari također imaju pravo nazivati se kemijskim spojevima ako se njihove molekule sastoje od atoma povezanih kovalentnom vezom (dušik, kisik, brom, fluor,). Ali bilo bi pogrešno inertne (plemenite) plinove i atomski vodik nazvati kemijskim spojevima.
Fizikalna klasifikacija tvari
Sa stajališta fizike, tvari postoje u nekoliko agregatnih stanja - tijelo, tekućina i plin. O tome kakve se čvrste tvari, na primjer, mogu vidjeti golim okom. Isto se može reći i za drugo agregatno stanje. Koje su tekuće tvari u prirodi, znamo iz škole. Važno je napomenuti da takva tvar kao što je voda može postojati u tri stanja odjednom - poput leda, tekuće vode i pare. Tri agregatna stanja tvari ne smatraju se pojedinačnim svojstvima tvari, već odgovaraju različitim, ovisno o vanjskim uvjetima postojanja tvari. U prijelazu iz stanja agregatnih stanja u realna stanja kemijski mogu se identificirati brojni međutipovi, koji se u znanosti nazivaju amorfna ili staklasta stanja, kao i stanje tekućeg kristala i stanje polimera. S tim u vezi, znanstvenici često koriste koncept "faze".
Osim ostalih, fizika razmatra i četvrto agregatno stanje kemijske tvari. Riječ je o plazmi, odnosno stanju koje je potpuno ili djelomično ionizirano, a gustoća pozitivnih i negativnih naboja u tom stanju je ista, drugim riječima, plazma je električki neutralna. Općenito, u prirodi postoji mnogo tvari, ali sada znate što su tvari, a to je mnogo važnije.
U životu smo okruženi raznim tijelima i predmetima. Na primjer, u zatvorenom prostoru to je prozor, vrata, stol, žarulja, šalica, na ulici - automobil, semafor, asfalt. Bilo koje tijelo ili predmet sastoji se od materije. Ovaj članak govori o tome što je tvar.
Što je kemija?
Voda je bitno otapalo i stabilizator. Ima veliki toplinski kapacitet i toplinsku vodljivost. Vodeni okoliš povoljne za odvijanje osnovnih kemijskih reakcija. Proziran je i praktički otporan na kompresiju.
Koja je razlika između anorganskih i organskih tvari?
Između ove dvije skupine tvari nema posebno jakih vanjskih razlika. Glavna razlika leži u strukturi, gdje anorganske tvari imaju nemolekularnu strukturu, a organske tvari imaju molekularnu strukturu.
Anorganske tvari imaju nemolekularnu strukturu, stoga ih karakterizira visoke temperature topljenje i vrenje. Ne sadrže ugljik. Tu spadaju plemeniti plinovi (neon, argon), metali (kalcij, kalcij, natrij), amfoterne tvari (željezo, aluminij) i nemetali (silicij), hidroksidi, binarni spojevi, soli.
Organske tvari molekularne strukture. Imaju dovoljno niske temperature tope, a zagrijavanjem se brzo raspadaju. Uglavnom se sastoji od ugljika. Iznimke: karbidi, karbonati, ugljikovi oksidi i cijanidi. Ugljik omogućuje stvaranje ogromnog broja složenih spojeva (u prirodi ih je poznato više od 10 milijuna).
Većina njihovih klasa pripada biološkom podrijetlu (ugljikohidrati, proteini, lipidi, nukleinske kiseline). Ovi spojevi uključuju dušik, vodik, kisik, fosfor i sumpor.

Da bismo razumjeli što je tvar, potrebno je zamisliti kakvu ulogu igra u našem životu. U interakciji s drugim tvarima stvara nove. Bez njih je životna aktivnost okolnog svijeta neodvojiva i nezamisliva. Svi predmeti sastoje se od određenih tvari, pa igraju važnu ulogu u našim životima.
Relativna molekulska masa - masa (amu) 6,02 × 10 23 molekule složene tvari. Brojčano jednaka molarnoj masi, ali se razlikuje po dimenzijama.
- Atomi u molekulama međusobno su povezani u određenom nizu. Promjena ovog slijeda dovodi do stvaranja nove tvari s novim svojstvima.
- Veza atoma odvija se u skladu s njihovom valencijom.
- Svojstva tvari ovise ne samo o njihovom sastavu, već i o " kemijska struktura”, odnosno od reda povezivanja atoma u molekulama i prirode njihovog međusobnog utjecaja. Atomi koji su međusobno izravno vezani imaju najjači utjecaj jedni na druge.
Toplinski učinak reakcije je toplina koju sustav oslobađa ili apsorbira tijekom strujanja u njemu kemijska reakcija. Ovisno o tome odvija li se reakcija uz oslobađanje topline ili je popraćena apsorpcijom topline, razlikuju se egzotermne i endotermne reakcije. Prvi, u pravilu, uključuje sve reakcije veze, a drugi - reakcije razgradnje.
Brzina kemijske reakcije- promjena količine jedne od reagirajućih tvari po jedinici vremena u jedinici reakcijskog prostora.
Unutarnja energija sustava- ukupna energija unutarnji sustav, koja uključuje energiju međudjelovanja i gibanja molekula, atoma, jezgri, elektrona u atomima, unutarnuklearnu i druge vrste energije, osim kinetičke i potencijalne energije sustava u cjelini.
Standardna entalpija (toplina) nastanka složene tvari- toplinski učinak reakcije stvaranja 1 mol ove tvari iz jednostavne tvari, koji su u stabilnom agregatnom stanju pod standardnim uvjetima (= 298 K i tlak od 101 kPa).
TVAR
TVAR
vrsta materije, koja za razliku od fizikalne. polja, ima masu mirovanja. U konačnici, val se sastoji od elementarnih čestica čiji mir nije jednak nuli (uglavnom od elektrona, protona, neutrona). U klasičnom V. fizike i fizikalne. polja su bila apsolutno suprotstavljena jedno drugom kao dvije vrste materije, od kojih je prva diskretna, a druga kontinuirana. Quantum, koji je uveo ideju duala. korpuskularno-valna priroda svakog mikroobjekta, dovela je do niveliranja ove suprotnosti. Otkriće bliskog međuodnosa između vode i polja dovelo je do produbljivanja ideja o strukturi materije. Na toj su osnovi V. i materija bili strogo razgraničeni, kroz pl. stoljeća, identificiran i s filozofijom i sa znanošću, i filozofija značaj je ostao kod kategorije tvari, a V. je zadržao znanstveni u fizici i kemiji. Vakuum se u zemaljskim uvjetima javlja u četiri stanja: plinovi, tekućine, čvrste tvari i plazma. Navodi se da V. može postojati i u posebnom, nadgustom (npr. u neutronu) stanje.
Vavilov S. I., Razvoj ideje o materiji, Sobr. op., T. 3, M., 1956, S.-41-62; Građa i oblici materije. [sub. Art.], M., 1967.
I. S. Aleksejev.
filozofski enciklopedijski rječnik. - M.: Sovjetska enciklopedija. CH. urednici: L. F. Iljičev, P. N. Fedosejev, S. M. Kovaljov, V. G. Panov. 1983 .
TVAR
blizak po značenju konceptu materija, ali ne i potpuno ekvivalentan. Dok se riječ "" uglavnom veže uz ideje o gruboj, inertnoj, mrtvoj stvarnosti, u kojoj dominiraju isključivo mehanički zakoni, supstanca je "materijal", koji zbog primanja oblika evocira oblik, životnu prikladnost, oplemenjenost. . Cm. Gestalt tkanje.
Filozofski enciklopedijski rječnik. 2010 .
TVAR
jedan od osnovnih oblika materije. V. uključuju makroskopske. tijela u svim agregatnim stanjima (plinovi, tekućine, kristali itd.) i čestice koje ih tvore i imaju vlastitu masu ("masa mirovanja"). U V. je poznat velik broj vrsta čestica: "elementarne" čestice (elektroni, protoni, neutroni, mezoni, pozitroni itd.), atomske jezgre, atomi, molekule, ioni, slobodni radikali, koloidne čestice, makromolekule itd. (vidi Elementarne čestice tvari).
Lit.: Engels F., Dijalektika prirode, Moskva, 1955.; njegov vlastiti, Anti-Dühring, M., 1957; V. I. Lenjin, Materijalizam i empiriokritika, Soch., 4. izdanje, vol. 14; Vavilov S. I., Razvoj ideje o materiji, Sobr. soč., vol. 3, M., 1956; njegov, Lenjin i moderno, ibid; njegov vlastiti, Lenjin i filozofski problemi moderne fizike, ibid.; Goldansky V., Leikin E., Transformacije atomskih jezgri, M., 1958.; Kondratiev V.N., Struktura i Kemijska svojstva molekule, M., 1953; "Advances in Physical Sciences", 1952., vol. 48, br. 2 (posvećen problemu mase i energije); Ovchinnikov N. F., Koncepti mase i energije ..., M., 1957; Kedrov B. M., Evolucija koncepta elementa u kemiji, M., 1956; Novozhilov Yu. V., Elementarne čestice, Moskva, 1959.
Filozofska enciklopedija. U 5 tomova - M .: Sovjetska enciklopedija. Uredio F. V. Konstantinov. 1960-1970 .
Sinonimi: