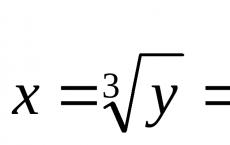Maksimalno oksidacijsko stanje mangana je. Mangan
Najviše oksidacijsko stanje mangana +7 odgovara kiselom oksidu Mn2O7, manganovoj kiselini HMnO4 i njegovim solima - permanganata.
Spojevi mangana (VII) jaki su oksidansi. Mn2O7 je zelenkastosmeđa uljasta tekućina, u dodiru s kojom se alkoholi i eteri zapale. Mn(VII) oksid odgovara manganovoj kiselini HMnO4. Postoji samo u otopinama, ali se smatra jednim od najjačih (α - 100%). Maksimalna moguća koncentracija HMnO4 u otopini je 20%. Soli HMnO4 – permanganati – najjači su oksidansi; u vodenim otopinama, poput same kiseline, imaju grimiznu boju.
U redoks reakcijama Permanganati su jaki oksidansi. Ovisno o reakciji okoline, reduciraju se ili u dvovalentne manganove soli (u kiseloj sredini), manganov (IV) oksid (u neutralnoj sredini) ili manganove (VI) spojeve - manganate - (u alkalnoj sredini). Očito je da su u kiseloj sredini oksidacijske sposobnosti Mn+7 najizraženije.
2KMnO4 + 5Na2SO3 + 3H2SO4 → 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2KMnO4 + 3Na2SO3 + H2O → 2MnO2 + 3Na2SO4 + 2KOH
2KMnO4 + Na2SO3 + 2KOH → 2K2MnO4 + Na2SO4 + H2O
Permanganati oksidiraju i u kiseloj i u alkalnoj sredini organska tvar:
2KMnO4 + 3H2SO4 + 5C2H5OH → 2MnSO4 + K2SO4 + 5CH3COH + 8H2O
aldehidni alkohol
4KMnO4 + 2NaOH + C2H5OH → MnO2↓ + 3CH3COH + 2K2MnO4 +
Kada se zagrijava, kalijev permanganat se raspada (ova reakcija se koristi za proizvodnju kisika u laboratoriju):
2KMnO4 K2MnO4 + MnO2 + O2
Tako, za mangan su karakteristične iste ovisnosti: pri prelasku iz nižeg oksidacijskog stanja u više, kisela svojstva kisikovih spojeva se povećavaju, au OM reakcijama redukcijska svojstva zamjenjuju se oksidativnim.
Permanganati su otrovni za tijelo zbog svojih jakih oksidacijskih svojstava.
Za trovanje permanganatom vodikov peroksid u octenoj kiselini koristi se kao protuotrov:
2KMnO4 + 5H2O2 + 6CH3COOH → 2(CH3COO)2Mn + 2CH3COOK + 5O2 + 8H2O
Otopina KMnO4 je kauterizirajuće i baktericidno sredstvo za tretiranje površine kože i sluznica. Snažna oksidacijska svojstva KMnO4 u kiseloj sredini temelj su analitičke metode permanganatometrije, koja se koristi u kliničkoj analizi za određivanje oksidabilnosti vode i mokraćne kiseline u urinu.
Ljudsko tijelo sadrži oko 12 mg Mn u različitim spojevima, od čega je 43% koncentrirano u koštano tkivo. Utječe na hematopoezu, stvaranje kostiju, rast, reprodukciju i neke druge funkcije tijela.
mangan(II) hidroksid ima slabo bazična svojstva, oksidira se atmosferskim kisikom i drugim oksidansima u permangansku kiselinu ili njezine soli manganiti:
Mn(OH)2 + H2O2 → H2MnO3↓ + H2O permanganska kiselina
(smeđi talog) U alkalnoj sredini Mn2+ oksidira u MnO42-, a u kiseloj u MnO4-:
MnSO4 + 2KNO3 + 4KOH → K2MnO4 + 2KNO2 + K2SO4 + 2H2O
Nastaju soli mangana N2MnO4 i mangana NMnO4 kiseline.
Ako u pokusu Mn2+ pokazuje redukcijska svojstva, onda su redukcijska svojstva Mn2+ slabo izražena. U biološkim procesima ne mijenja oksidacijsko stanje. Stabilni Mn2+ biokompleksi stabiliziraju ovo oksidacijsko stanje. Stabilizirajući učinak pojavljuje se u dugom vremenu zadržavanja hidratacijske ljuske. Manganov(IV) oksid MnO2 je stabilan prirodni spoj mangana koji se nalazi u četiri modifikacije. Sve modifikacije su amfoterne prirode i imaju redoks dvojnost. Primjeri redoks dualnosti MnO2: MnO2 + 2KI + 3SO2 + N2O → I2 + MnSO3 + 2KNSO3
6MnO2 + 2NH3 → 3Mn2O3 + N2 + 3H2O
4MnO2 + 3O2 + 4KOH → 4KMnO4 + 2H2O
Mn(VI) spojevi- nestabilno. U otopinama mogu prijeći u spojeve Mn (II), Mn (IV) i Mn (VII): manganov oksid (VI) MnO3 je tamnocrvena masa koja izaziva kašalj. Hidratni oblik MnO3 je slaba permanganska kiselina H2MnO4, koja postoji samo u vodenoj otopini. Njegove soli (manganati) lako se uništavaju hidrolizom i zagrijavanjem. Na 50°C MnO3 se raspada:
2MnO3 → 2MnO2 + O2 i hidrolizira kada se otopi u vodi: 3MnO3 + H2O → MnO2 + 2HMnO4
Derivati Mn(VII) su manganov (VII) oksid Mn2O7 i njegov hidratni oblik – kiselina NMnO4, poznata samo u otopini. Mn2O7 je stabilan do 10°C, eksplozivno se raspada: Mn2O7 → 2MnO2 + O3
Kada se otopi u hladna voda nastaje kiselina Mn2O7 + H2O → 2NMnO4
Soli manganske kiseline NMnO4- permanganata. Ioni uzrokuju ljubičastu boju otopina. Tvore kristalne hidrate tipa EMnO4∙nH2O, gdje je n = 3-6, E = Li, Na, Mg, Ca, Sr.
Permanganat KMnO4 je visoko topljiv u vodi . Permanganati - jaka oksidirajuća sredstva. Ovo se svojstvo koristi u medicinskoj praksi za dezinfekciju, u farmakopejskoj analizi za identifikaciju H2O2 interakcijom s KMnO4 u kiseloj sredini.
Permanganati su otrovi za tijelo, njihova neutralizacija se može dogoditi na sljedeći način: 2KMnO4 + 5H2O2 + 6CH3COOH = 2Mn(CH3COO)2 + 2CH3COOK + 8H2O + 5O2
Za liječenje akutnog trovanja permanganatom koristi se 3% vodena otopina H2O2 zakiseljena octenom kiselinom. Kalijev permanganat oksidira organske tvari u stanicama tkiva i mikroba. U tom slučaju KMnO4 se reducira u MnO2. Mangan(IV) oksid također može reagirati s proteinima stvarajući smeđi kompleks.
Pod utjecajem kalijevog permanganata KMnO4 proteini se oksidiraju i koaguliraju. Na temelju ovoga njegovu primjenu kao vanjski pripravak s antimikrobnim i kauterizirajućim svojstvima. Štoviše, njegov se učinak očituje samo na površini kože i sluznice. Oksidativna svojstva vodene otopine KMnO4 koristiti za neutralizaciju otrovnih organskih tvari. Kao rezultat oksidacije nastaju manje toksični produkti. Na primjer, lijek morfin se pretvara u biološki neaktivan oksimorfin. Kalijev permanganat primijeniti u titrimetrijskoj analizi za određivanje sadržaja raznih redukcijskih sredstava (permanganatometrija).
Visoka oksidacijska sposobnost permanganata koristiti u ekologiji za procjenu onečišćenja otpadnih voda (permanganatna metoda). Količina oksidiranog (promijenjenog) permanganata određuje sadržaj organskih nečistoća u vodi.
Koristi se permanganatna metoda (permanganatometrija). također u kliničkim laboratorijima za određivanje razine mokraćne kiseline u krvi.
Soli manganove kiseline nazivaju se permanganati. Najpoznatija je kalijeva permanganatna sol KMnO4 - tamnoljubičasta kristalna tvar, umjereno topljiva u vodi. Otopine KMnO4 imaju tamnocrvenu boju, a pri visokim koncentracijama - ljubičastu, karakterističnu za anione MnO4.
Permanganat kalij se zagrijavanjem raspada
2KMnO4 = K2MnO4 + MnO2 + O2
Kalijev permanganat je vrlo jak oksidans, lako oksidira mnoge anorganske i organske tvari. Stupanj redukcije mangana uvelike ovisi o pH okoliša.
Oporavak Kalijev permanganat u sredinama različite kiselosti odvija se prema sljedećoj shemi:
Kiseli pH<7
mangan(II) (Mn2+)
KMnO4 + redukcijsko sredstvo Neutralno okruženje pH = 7
mangan(IV) (MnO2)
Alkalna sredina pH>7
mangan(VI) (MnO42-)
Mn2+ diskoloracija otopine KMnO4
MnO2 smeđi talog
Otopina MnO42 postaje zelena
Primjeri reakcija uz sudjelovanje kalijevog permanganata u različitim okruženjima (kiselim, neutralnim i alkalnim).
pH<7 5K2SO3 + 2KMnO4 + 3H2SO4= 2MnSO4 + 6K2SO4 + 3H2O
MnO4 - +8H++5℮→ Mn2++ 4H2O 5 2
SO32- + H2O - 2ē → SO42-+2H+ 2 5
2MnO4 - +16H++ 5SO32- + 5H2O → 2Mn2++ 8H2O + 5SO42-+10H+
2MnO4 - +6H++ 5SO32- → 2Mn2++ 3H2O + 5SO42-
pH = 7 3K2SO3 + 2KMnO4 + H2O = 2MnO2 + 3K2SO4 + 2KOH
MnO4- + 2H2O+3ē = MnO2 + 4OH- 3 2
SO32- + H2O - 2ē → SO42-+2H+- 2 3
2MnO4 - +4H2O + 3SO32- + 3H2O → 2MnO2 + 8OH- + 3SO42-+6H+ 6H2O + 2OH-
2MnO4 - + 3SO32- + H2O → 2MnO2 + 2OH- + 3SO42
pH>7 K2SO3 + 2KMnO4 + 2KOH = 2K2MnO4 + K2SO4 + N2O
MnO4- +1 ē → MnO42- 1 2
SO32- + 2OH- - 2ē → SO42-+ H2O 2 1
2MnO4- + SO32- + 2OH- →2MnO42- + SO42-+ H2O
Koristi se kalijev permanganat KMnO4 u medicinskoj praksi kao dezinficijens i antiseptik za ispiranje rana, ispiranje, ispiranje itd. Svjetloružičasta otopina KMnO4 koristi se oralno za ispiranje želuca u slučaju trovanja.
Kalijev permanganat se vrlo široko koristi kao oksidacijsko sredstvo.
Pomoću KMnO4 analiziraju se mnogi lijekovi (na primjer, postotna koncentracija (%) otopine H2O2).
opće karakteristike d-elementi VIIIB podskupine. Građa atoma. Elementi obitelji željeza. Oksidacijska stanja u spojevima. Tjelesni i Kemijska svojstvažlijezda. Primjena. Rasprostranjenost i oblici pojavljivanja d-elemenata obitelji željeza u prirodi. Soli željeza (II, III). Kompleksni spojevi željeza (II) i željeza (III).
Opća svojstva elementi VIIIB podskupine:
1) Općenito elektronska formula posljednje razine (n - 1)d(6-8)ns2.
2) U svakom razdoblju postoje 3 elementa u ovoj skupini, koji tvore trijade (obitelji):
a) Porodica željeza: željezo, kobalt, nikal.
b) Familija lakih metala platine (familija paladija): rutenij, rodij, paladij.
c) Familija teških platinskih metala (platina familija): osmij, iridij, platina.
3) Sličnost elemenata u svakoj obitelji objašnjava se blizinom atomskih radijusa, stoga je gustoća unutar obitelji bliska.
4) Gustoća raste s povećanjem broja perioda (atomski volumeni su mali).
5) To su metali sa visoke temperature topljenje i vrenje.
6) Maksimalno oksidacijsko stanje pojedinih elemenata raste s brojem periode (za osmij i rutenij doseže 8+).
7) Ovi metali su sposobni ugraditi atome vodika u kristalnu rešetku; u njihovoj prisutnosti pojavljuje se atomski vodik - aktivni redukcijski agens. Stoga su ti metali katalizatori za reakcije koje uključuju dodavanje atoma vodika.
8) Spojevi ovih metala su obojeni.
9) Karakteristika oksidacijska stanja za željezo +2, +3, u nestabilnim spojevima +6. Nikal ima +2, nestabilni imaju +3. Platina ima +2, nestabilna ima +4.
Željezo. Dobivanje željeza(sve ove reakcije događaju se pri zagrijavanju)
*4FeS2 + 11O2 = 2Fe2O3 + 8SO2. Stanje: pečenje željeznog pirita.
*Fe2O3 + 3H2 = 2Fe + 3H2O. *Fe2O3 + 3CO = 2Fe + 3CO2.
*FeO + C = Fe + CO.
*Fe2O3 + 2Al = 2Fe + Al2O3 (termitna metoda). Stanje: grijanje.
* = Fe + 5CO (razgradnjom željeznog pentakarbonila dobiva se vrlo čisto željezo).
Kemijska svojstva željeza Reakcije s jednostavnim tvarima
*Fe + S = FeS. Stanje: grijanje. *2Fe + 3Cl2 = 2FeCl3.
*Fe + I2 = FeI2 (jod je manje jak oksidans od klora; FeI3 ne postoji).
*3Fe + 2O2 = Fe3O4 (FeO Fe2O3 je najstabilniji željezni oksid). Fe2O3 nH2O nastaje u vlažnom zraku.
1. DIO
1. Oksidacijsko stanje (s.o.) je konvencionalni naboj atoma kemijskog elementa u složenoj tvari, izračunat na temelju pretpostavke da se sastoji od jednostavnih iona.
Trebate znati!
1) U vezi s. O. vodik = +1, osim za hidride .
2) U vezi s. O. kisik = -2, osim peroksida  i fluorida 
3) Oksidacijsko stanje metala uvijek je pozitivno.
Za metale glavnih podskupina prva tri grupe s. O. konstantno:
Metali IA skupine - str. O. = +1,
Metali skupine IIA - str. O. = +2,
Metali IIIA skupine - str. O. = +3. 4
U slobodnim atomima i jednostavne tvari S. O. = 0,5
Ukupno s. O. svi elementi u vezi = 0.
2. Način tvorbe imena dvoelementni (binarni) spojevi.

4. Ispunite tablicu “Imena i formule binarnih spojeva.”

5. Odredite oksidacijsko stanje fontom istaknutog elementa kompleksnog spoja.

2. DIO
1. Odredite oksidacijska stanja kemijskih elemenata u spojevima pomoću njihovih formula. Napiši nazive tih tvari.

2. Tvari FeO, Fe2O3, CaCl2, AlBr3, CuO, K2O, BaCl2, SO3 podijeli u dvije skupine. Napiši nazive tvari s naznakom njihova oksidacijskog stanja.

3. Uspostavite korespondenciju između naziva i oksidacijskog stanja atoma kemijskog elementa i formule spoja.

4. Sastavite formule za tvari po nazivima.

5. Koliko se molekula nalazi u 48 g sumporovog (IV) oksida?

6. Koristeći internet i druge izvore informacija pripremite poruku o korištenju bilo kojeg binarnog spoja prema sljedećem planu:
1) formula;
2) naziv;
3) svojstva;
4) primjena.
H2O voda, vodikov oksid. Voda je u normalnim uvjetima tekućina, bez boje, mirisa i plava u debelom sloju. Vrelište je oko 100⁰S. Dobro je otapalo. Molekula vode sastoji se od dva atoma vodika i jednog atoma kisika, to je njezin kvalitativni i kvantitativni sastav. Ovo je složena tvar, karakterizirana je sljedećim kemijskim svojstvima: interakcija s alkalijskim metalima, zemnoalkalijskim metalima.
Reakcije izmjene s vodom nazivaju se hidroliza. Ove reakcije su od velike važnosti u kemiji.
7. Oksidacijsko stanje mangana u spoju K2MnO4 jednako je:
8. Krom ima najniže oksidacijsko stanje u spoju čija je formula:
1) Cr2O3
9. Maksimalni stupanj Klor pokazuje oksidaciju u spoju čija je formula:
Mangan je tvrdi metal Siva boja. Njegovi atomi imaju elektronička konfiguracija vanjska ljuska
Metalni mangan reagira s vodom i reagira s kiselinama stvarajući ione mangana(II):
U različitim spojevima, mangan pokazuje oksidacijska stanja. Što je više oksidacijsko stanje mangana, to je veća kovalentna priroda njegovih odgovarajućih spojeva. Povećanjem stupnja oksidacije mangana raste i kiselost njegovih oksida.
mangan(II)
Ovaj oblik mangana je najstabilniji. Ima vanjsku elektroničku konfiguraciju s jednim elektronom u svakoj od pet orbitala.
U vodenoj otopini ioni mangana(II) hidratiziraju se da bi se formirao blijedoružičasti kompleksni ion, heksaakvamangan(II). Ovaj je ion stabilan u kiselim sredinama, ali stvara bijeli talog manganovog hidroksida u alkalnim sredinama. Mangan(II) oksid ima svojstva osnovnih oksida.
mangan (III)
Mangan (III) postoji samo u kompleksnim spojevima. Ovaj oblik mangana je nestabilan. U kiseloj sredini mangan(III) disproporcionira u mangan(II) i mangan(IV).
mangan (IV)
Najvažniji spoj mangana(IV) je oksid. Ovaj crni spoj je netopljiv u vodi. Pripisuje mu se ionska struktura. Stabilnost je posljedica visoke entalpije rešetke.
Mangan(IV) oksid ima slabo amfoterna svojstva. Jako je oksidacijsko sredstvo, na primjer istiskuje klor iz koncentrirane klorovodične kiseline:
Ova se reakcija može koristiti za proizvodnju klora u laboratoriju (vidi odjeljak 16.1).
mangan(VI)
Ovo oksidacijsko stanje mangana je nestabilno. Kalijev manganat (VI) može se dobiti spajanjem manganova (IV) oksida s nekim jakim oksidacijskim sredstvom, na primjer kalijevim kloratom ili kalijevim nitratom:
Kalijev manganat (VI) je zelene boje. Stabilan je samo u alkalnoj otopini. U kiseloj otopini disproporcionira u mangan (IV) i mangan (VII):
mangan (VII)
Mangan ima ovo oksidacijsko stanje u visokom kiseli oksid. Ipak, najvažniji spoj mangana(VII) je kalijev manganat(VII) (kalijev permanganat). Ova se krutina vrlo dobro otapa u vodi, stvarajući tamnoljubičastu otopinu. Manganat ima tetraedarsku strukturu. U blago kiselom okruženju postupno se raspada, stvarajući mangan (IV) oksid:
U alkalnoj sredini kalijev manganat(VII) se reducira, stvarajući najprije zeleni kalijev manganat(VI), a zatim manganov(IV) oksid.
Kalijev manganat (VII) je jako oksidacijsko sredstvo. U dovoljno kiseloj sredini se reducira, stvarajući ione mangana(II). Standardni redoks potencijal ovog sustava je , što premašuje standardni potencijal sustava i stoga manganat oksidira kloridni ion u plinoviti klor:
Oksidacija manganat klorid iona odvija se prema jednadžbi
Kalijev manganat(VII) naširoko se koristi kao oksidacijsko sredstvo u laboratorijskoj praksi, npr.
za proizvodnju kisika i klora (vidi poglavlja 15 i 16);
provesti analitičko ispitivanje sumporovog dioksida i sumporovodika (vidi Poglavlje 15); u preparativnoj organskoj kemiji (vidi Poglavlje 19);
kao volumetrijski reagens u redoks titrimetriji.
Primjer titrimetrijske uporabe kalijevog manganata (VII) je kvantitativno određivanje uz njegovu pomoć željeza (II) i etandioata (oksalata):
Međutim, budući da je kalijev manganat (VII) teško dobiti iz visok stupanjčistoće, ne može se koristiti kao primarni titrimetrijski standard.
Olimpijski zadaci iz kemije
(1 školska faza)
1. Testirajte
1. Mangan ima najviše oksidacijsko stanje u spoju
2. Reakcija neutralizacije odgovara skraćenoj ionskoj jednadžbi
1) H + + OH - = H 2 O
2) 2H + + CO 3 2- = H 2 O + CO 2
3) CaO + 2H + = Ca 2+ + H 2 O
4) Zn + 2H + = Zn 2+ + H 2
3. Međusobno komunicirajte
2) MnO i Na2O
3) P 2 O 5 i SO 3
4. Jednadžba za redoks reakciju je
1) KOH + HNO 3 = KNO 3 + H 2 O
2) N 2 O 5 + H 2 O = 2 HNO 3
3) 2N 2 O = 2N 2 + O 2
4) BaCO 3 = BaO + CO 2
5. Reakcija izmjene je interakcija
1) kalcijev oksid s dušičnom kiselinom
2) ugljikov monoksid s kisikom
3) etilen s kisikom
4) klorovodična kiselina s magnezijem
6. Kisele kiše uzrokovane su prisutnošću u atmosferi
1) dušikovi i sumporni oksidi
4) prirodni plin
7. Metan se uz benzin i dizelsko gorivo koristi kao pogonsko gorivo u motorima (vozilima) s unutarnjim izgaranjem. Termokemijska jednadžba za izgaranje plina metana je:
CH 4 + 2O 2 = CO 2 + 2H 2 O + 880 kJ
Kolika će se količina kJ topline osloboditi pri izgaranju CH 4, obujma 112 litara (na nuli)?
Izaberi točan odgovor:
2. Ciljevi
1. U jednadžbi redoks reakcije rasporedite koeficijente na bilo koji vama poznat način.
SnSO 4 + KMnO 4 + H 2 SO 4 = Sn(SO 4) 2 + MnSO 4 + K 2 SO 4 + H 2 O
Navedite nazive oksidirajuće tvari i redukcijske tvari te oksidacijsko stanje elemenata. (4 boda)
2. Napišite jednadžbe reakcija koje omogućuju sljedeće transformacije:
(2) (3) (4) (5)
CO 2 → Ca(HCO 3) 2 → CaCO 3 → CaO → CaCl 2 → CaCO 3
(5 bodova)
3. Odredite formulu alkadiena ako je njegova relativna gustoća u zraku 1,862 (3 boda)
4. Godine 1928. američki kemičar iz korporacije General Motors Research, Thomas Midgley Jr., uspio je u svom laboratoriju sintetizirati i izolirati kemijski spoj koji se sastoji od 23,53% ugljika, 1,96% vodika i 74,51% fluora. Dobiveni plin bio je 3,52 puta teži od zraka i nije izgorio. Izvedi formulu spoja, napiši strukturne formule organskih tvari koje odgovaraju dobivenoj molekulskoj formuli i daj im imena. (6 bodova).
5. Pomiješati 140 g 0,5% otopine klorovodične kiseline s 200 g 3% otopine klorovodične kiseline. Koliki je postotak klorovodične kiseline u novodobivenoj otopini? (3 boda)
3. Križaljka
Riješite riječi šifrirane u križaljci
Oznake: 1→ - vodoravno
1↓ - okomito
↓ Proizvod korozije željeza.
→ Nastaje interakcijom (6) s glavnim oksidom.
→ Jedinica za količinu topline.
→ Pozitivno nabijen ion.
→ Talijanski znanstvenik po kojem je nazvana jedna od najvažnijih konstantnih veličina.
→ Broj elektrona u vanjskoj razini elementa br. 14.
→……plin – ugljikov monoksid (IV).
→ Veliki ruski znanstvenik, poznat, između ostalog, kao kreator mozaičkih slika i autor epigrafa.
→ Vrsta reakcije između otopina natrijevog hidroksida i sumporne kiseline.
Navedite primjer jednadžbe reakcije za (1→).
Navedite konstantu navedenu u (4).
Napišite jednadžbu reakcije (8).
Napiši elektroničku strukturu atom elementa, koji se spominje u (5). (13 bodova)