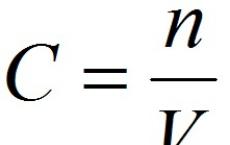Kako najti koncentracijo snovi v fiziki. Koncentracija raztopin
Lahko se izrazi tako v brezdimenzionalnih enotah (frakcije, odstotki) kot v dimenzijskih količinah (masni deleži, molarnost, titri, molske frakcije).
Koncentracija- to je količinska sestava raztopljene snovi (v specifičnih enotah) na enoto prostornine ali mase. Označite topljenec - X, in topilo - S. Najpogosteje uporabljam pojma molarnost (molarna koncentracija) in molski delež.
1. (ali odstotna koncentracija snovi) je razmerje med maso raztopljene snovi m na celotno maso raztopine. Za binarno raztopino, ki jo sestavljata topljenec in topilo:
ω - masni delež raztopljene snovi;
m in-va- masa raztopljene snovi;
mrešitev- masa topila.
Masni delež je izražen v delih enote ali v odstotkih.
2. Molarna koncentracija oz molarnost je število molov topljenca v enem litru raztopine V:
 ,
,
C- molska koncentracija raztopljene snovi, mol/l (možna je tudi oznaka M, na primer 0,2 MHCl);
n
V- prostornina raztopine, l.
Rešitev se imenuje molar oz unimolarni, če 1 mol snovi raztopimo v 1 litru raztopine, decimolarno- 0,1 mol snovi se raztopi, centimolar- 0,01 mola snovi se raztopi, milimolarno- 0,001 mola snovi se raztopi.
3. Molalna koncentracija(molnost) raztopine C(x) prikazuje število molov n raztopljene snovi v 1 kg topila m:
 ,
,
C(x)- molalnost, mol/kg;
n- količina raztopljene snovi, mol;
mr-la- masa topila, kg.
4. - vsebnost snovi v gramih v 1 ml raztopine:
 ,
,
T- titer raztopljene snovi, g/ml;
m in-va- masa raztopljene snovi, g;
V rešitev- prostornina raztopine, ml.
5. - brezdimenzijska količina, ki je enaka razmerju količine raztopljene snovi n na skupno količino snovi v raztopini:
 ,
,
n- molski delež raztopljene snovi;
n- količina raztopljene snovi, mol;
n r-la- količina topila, mol.
Vsota molskih deležev mora biti enaka 1:
N(X) + N(S) = 1.
Kje n(X) X;
n(S) - molski delež topljenca S.
Včasih je pri reševanju problemov treba preiti iz ene izrazne enote v drugo:

ω(X) - masni delež raztopljene snovi, v %;
M(X)- molska masa raztopljene snovi;
ρ = m/(1000 V) je gostota raztopine.6. - število gramskih ekvivalentov določene snovi v enem litru raztopine.
Gramski ekvivalent snovi- število gramov snovi, številčno enako njenemu ekvivalentu.
Enakovredno je običajna enota, ki ustreza enemu vodikovemu ionu v kislinsko-bazičnih reakcijah ali enemu elektronu v redoks reakcijah.
Za zapis koncentracije takih raztopin se uporabljajo okrajšave n oz n. Na primer, raztopina, ki vsebuje 0,1 mol-eq/l, se imenuje decinormalna in jo zapišemo kot 0,1 n.
 ,
,
C N- normalna koncentracija, mol-ekviv/l;
z- ekvivalentno število;
V rešitev- prostornina raztopine, l.
Topnost snov S - največja masa snovi, ki se lahko raztopi v 100 g topila:

Koeficient topnosti- razmerje med maso snovi, ki pri določeni temperaturi tvori nasičeno raztopino, in maso topila:

0 - povprečna absolutna temperatura zaslona v °K; Cs - konstanta sevanja črnega telesa
Cs = 4,88 - konstanta sevanja črnega telesa.
V,. = 639 + 273 = 906 °K C3 = 4,88 - konstanta sevanja črnega telesa.
kjer je Cs konstanta sevanja črnega telesa, Cs = 5,67 W/; Hs - ekvivalentna absolutno črna površina, m2; Тп - temperatura produktov zgorevanja na prehodu, K; 9 - povprečna površinska temperatura
kjer je Yar.Tr površina sevalnih cevi, m2; Gmax - najvišja temperatura zgorevanja, K; Go - povprečna temperatura zaslona, K; с$ konstanta sevanja črnega telesa; cg = 5,67 W/.
kjer je Cs radiacijska konstanta absolutno črnega telesa, enaka 5,67 W/; Hs - ekvivalentna absolutno črna površina, m2; Тп - temperatura plinov, ki zapuščajo peč, K; 0 - povprečna temperatura zunanje površine sevalnih cevi, K.
kjer sta dr in drk toplotna intenzivnost sevalnih cevi, skupna in pripisana prosti konvekciji, W/m2; НР/Н5 - razmerje med površino sevalnih cevi Нр in ekvivalentno absolutno črno površino Hs, odvisno od vrste peči in načina zgorevanja goriva; 9 - povprečna temperatura zunanje stene sevalnih cevi, K; \)))/ - koeficient, odvisen od porazdelitve temperature v kurišču, vrste peči in vrste goriva; Cs je radiacijska konstanta popolnoma črnega telesa, enaka 5,67 W/.
kjer je cs konstanta sevanja črnega telesa, enaka
C = 5,67 W/=20,77 kJ/-konstanta sevanja črnega telesa.
kjer sta ca in cn prostorninska toplotna kapaciteta dimnih plinov pri temperaturi zgorevanja goriva Ta in temperaturi dimnih plinov pri prehodu Gп, kJ/; pri - stopnja črnine kurišča; st - konstanta sevanja peči, W/.
kjer je c" konstanta sevanja, kcal/; d je premer zrna, m.
Konec gorenja površinskega koksa je določen s temperaturo v reaktorjih in vsebnostjo kisika v dimnih plinih za reaktorjem. Konstantna koncentracija kisika na vstopu in izstopu iz reaktorja nakazuje konec izgorevanja. Zadnja regeneracijska doba, povezana s povišanjem temperature plina na izhodu iz peči, je potrebna za izgorevanje globokega, težko oksidirajočega koksa. Po koncu obdobja izgorevanja površinskega koksa nadaljujejo s kalcinacijo katalizatorja, ki se pojavi pri višji temperaturi na izhodu iz peči, zato se glede na konstrukcijske pogoje tlak med kalcinacijo zmanjša ali ostane pri isti nivo.
Dušikov ion se odstrani iz reaktivnih aromatskih spojin s skoraj enako hitrostjo, pri kateri nastane. Zato je opažena hitrost reakcije k", enaka je za vse aromatske spojine z zadostno aktivnostjo. Pri manj reaktivnih aromatskih spojinah je lahko reakcija reverzibilna, tako da se vzpostavi konstantna koncentracija nitronijevega iona. Skupna hitrost bo potem odvisno od koncentracije in strukture aromatske spojine.
1. Neprekinjeno dovajanje sveže kisline in neprekinjeno odstranjevanje izrabljene kisline. V tem primeru sistem ohranja konstantno koncentracijo kisline okoli 88%.
Z intradifuzijskim mehanizmom se preostali koks nabira le v središču delca katalizatorja. Količina nastalega koksa se iz cikla v cikel zmanjšuje, količina zgorelega koksa pa ostaja nespremenjena. Konstantna koncentracija ostanka koksa se vzpostavi, ko je dosežena največja koncentracija koksa v središču delca.
vneseni delci po celotnem volumnu reakcijske zmesi, ki polni reaktor, in konstantna koncentracija reaktantov v vsaki stopnji.
Običajno se vzdržuje konstantna koncentracija 30 %.
Stalna koncentracija pinena na katalitični površini je
Konstantna koncentracija pinena na površini katalizatorja lahko nastane le, če je adsorpcija pinena na površini katalizatorja večkrat večja od adsorpcije reakcijskih produktov, ki se ob nastanku takoj izpodrinejo s površine in pride do dovolj dober prenos mase v sistemu, da se zagotovi potreben dotok pinena na površinski katalizator.
Esterifikacija pentazola z ocetno kislino se periodično izvaja v bakrenem vodoravnem kotlu, opremljenem s kolono z bakrenimi ploščami. Reakcija poteka med amilnimi alkoholi in 40% ocetno kislino v prisotnosti koncentrirane žveplove kisline in segreto do vrelišča. Ocetno kislino uvajamo postopoma, tako da ves čas vzdržujemo konstantno koncentracijo 4 %. Destilacija se izvaja z namakanjem; produkt se zbira v vodnem separatorju. Reakcijo izvajamo tako dolgo, dokler v proces vnešeni alkoholi popolnoma ne odženejo.
V kontinuiranem procesu se tereftalna kislina med oksidacijo obori zaradi prisotnosti velikih količin koncentrirane ocetne kisline v mešanici. Mešanica vsebuje 48,5 delov l-ksilena, 125 delov ledocetne kisline, 0,6 delov manganovega acetata in 0,5 delov amonijevega bromida. V tem primeru je pretvorba nekoliko večja, vendar če ne vzdržujemo konstantne koncentracije ocetne kisline, izkoristek ne preseže 75 %.
Način vnosa pufra v razelektritev je odvisen od vloge, ki jo opravlja. Če je pufer namenjen le stabilizaciji temperature plazme, ga je mogoče vnesti v območje razelektritve na kateri koli primeren način.V tem primeru je naložena ena osnovna zahteva: stalna koncentracija puferskih elementov v oblaku razelektritve.
Mentalno koncentracijo lahko definiramo kot sposobnost osredotočanja pozornosti na eno stvar in izključitev vsega drugega. Običajno se lahko osredotočimo le na tiste stvari, ki nas resnično zanimajo, težko pa smo nenehno pozorni na stvari, ki nas ne zanimajo posebej.
V nasprotju s splošnim prepričanjem intenzivna koncentracija na določeno nalogo ne povzroči večje porabe energije, nasprotno, zmanjša se. V praksi, ko človek poskuša varčevati z energijo, opravlja svoje delo brez želje, saj misli, da mu manj napora omogoča, da porabi manj energije. Človek pa se ne zaveda, da pomanjkanje entuziazma vodi v sobivanje dveh nasprotujočih si položajev: notranjega odpora do dela in nujne potrebe po tem.
Živčna napetost je vedno posledica delovanja nasprotujočih si sil, kar privede do psihofizične razcepljenosti človeka. V odsotnosti dvojnosti ima človek boljši nadzor nad samim seboj in se izogne zapravljanju energije, ki je neizogibno pri fokusiranju na več predmetov hkrati. Vemo, da tesnoba občutno izčrpa obrambne mehanizme telesa, povzroči živčno napetost in povzroči, da človek »dela za izčrpanost«. Vse, na kar usmerimo svojo pozornost, nas začne v večji ali manjši meri »motiti«. Če je naša pozornost usmerjena na več stvari hkrati, kot v zgodbi Charlesa M., podani v poglavju »Resnični obstoj in domišljijsko življenje«, to močno poveča stopnjo tesnobe. Mnoge naše zaznave, tudi subliminalne, nam ustvarjajo problem, torej spodbudo za odločitev, sklep ali določeno psihološko stanje. Na primer, dogodek na ulici, ki nas neposredno ne zadeva, povzroči intenzivno delo podzavesti v naših možganih kot odgovor na nezavedno tesnobo.
Predstavljajmo si, da med listanjem časopisa naletimo na zaskrbljujoč naslov in se nejasno zavedamo, da pomeni vojno grožnjo na določeni točki planeta. Lahko se zgodi, da naša podzavest, prestrašena nad takšnim obetom, takoj začne kovati načrte, kako si v takem primeru zagotoviti varnost. Za nezavedno domišljijo bo to ostal nerešen problem, ki ga bo treba rešiti tako ali drugače in nas bo verjetno še dolgo mučil, sploh če nas bodo dosegle še druge podobne novice. To je samo ena od mnogih zaznav, ki jih imamo čez dan. K tem je treba prišteti še vse tiste, ki so shranjeni v našem spominu in ki zlahka pridejo na površje zavesti, če nimamo določene sposobnosti mentalne koncentracije.
Več stvari kot mora človek v določenem trenutku vključiti v polje svoje pozornosti, bolj razdrobljen postaja njegov »jaz«. Zaradi tega postane nemogoče doseči visoko raven zavesti, za katero je značilna prisotnost nedeljivega, celovitega in zrelega »jaza«.
Obstaja veliko stopenj mentalne koncentracije, ki ustrezajo intenzivnosti pozornosti. Če pustimo ob strani to stopnjevanje, bomo razlikovali med dvema glavnima vrstama mentalne koncentracije: intenzivno koncentracijo in umirjeno koncentracijo. Vsaka od njih je lahko prostovoljna ali neprostovoljna. Koncentracija je prostovoljna, ko obstaja namerna želja usmeriti pozornost na eno stvar in izključiti vse ostalo, in neprostovoljna, ko um zajame kakšen dražljaj. Upoštevali bomo samo poljubno koncentracijo.
Prostovoljna koncentracija je intenzivna, ko jo spremlja mišični napor, katerega cilj je fiksiranje in poživitev mentalne slike, abstraktne ali konkretne. Pogosto, ko se poskušajo osredotočiti na nekaj, ljudje napnejo obrazne mišice, na primer, se namrščijo, stisnejo čeljusti, kar samo po sebi povzroči stanje živčne napetosti.
Zadržimo se pri enem izjemno zanimivem dejstvu, ki je neposredno povezano s temo, o kateri tukaj govorimo. Govorimo o nekaterih posledicah stanja napetosti, ki se jih še nismo dotaknili.
Prej smo napetost obravnavali kot patologijo, torej kot »prekomerno napetost«, in analizirali škodo, ki jo lahko povzroči človeškemu telesu. Kljub temu pa je stanje napetosti, kot smo že omenili v prvem poglavju, naravno in nujno za aktivno življenje. Napetost postane škodljiva le, če je pretirana. Če govorimo o inteligenci, potem je glavna težava ljudi ravno nasprotna od pojava živčne napetosti. V tem primeru pride do "patološke atonije". Miselno koncentracijo definirajmo kot napetost domišljije, raztresenost pa kot atonijo domišljije. Napetosti »čiste« domišljije ne smemo zamenjevati s stanjem čustvenega nemira, ki povzroča tesnobne misli, ki vodijo v pretirano napetost. V tem primeru pride do neprostovoljne koncentracije brez sodelovanja "jaza". Zavestna koncentracija je vedno premišljeno dejanje Jaza.
Intelektualna atonija ali atonija "jaza" je pomanjkanje zavestnega razmišljanja in prevlada podzavestne dejavnosti.
Glavni cilj hipozavesti je, kot smo že povedali in kar dokazuje že samo ime, doseganje višje stopnje zavesti. Zavest lahko povečate s krepitvijo in doseganjem polne zrelosti »jaza«. Koncentracija bistveno poveča človekov mentalni tonus in mu omogoči, da v celoti uporabi svojo voljo in ustvarjalno razmišljanje.
Jean-Claude Fillou v svoji knjigi »Duševni ton« piše naslednje: »Volja, pogum, vztrajnost, samokontrola in sposobnost ostati miren v težkih trenutkih pomenijo stanja, v katerih ima celota človekove energije posebej visok ton. . Nasprotno pa imajo ljudje, ki so pasivni, inertni in lahko razburljivi, zelo nizek tonus, saj svojo moč zapravljajo zaman. Sem sodijo tudi asteniki vseh vrst, nepotrpežljivi, neodločni in nemočni ljudje – z eno besedo tisti, za katere se zdi, da so samo igra zunanjih sil, namesto da bi se uveljavili z aktivnim, zavestnim prilagajanjem zunanjemu svetu in pustili svoj pečat. na njem.« »Vztrajen človek ima na primer visoko vitalnost, ker zna uporabiti svojo moč. Nestabilna in impulzivna oseba nima dovolj tonusa, saj nepravilno uporablja svoje moči in jih slabo upravlja.”
Lahko bi rekli, da pomanjkanje mentalnega tonusa pomeni "šibkost zavesti" zaradi nizke stopnje "prebujenosti" in seveda napačnega treninga, ki spremlja nizko stopnjo zavesti.
Glede razmerja med koncentracijo in porabo energije se običajno trdi, da ker koncentracija zahteva veliko truda, njena visoka raven ne more pomagati pri zmanjševanju porabe energije. Pravzaprav tiha koncentracija ne zahteva veliko truda in je sposobnost mirnega zadrževanja miselne slike. Nasprotno, koncentracija, ki jo spremlja precejšen živčni napor, nedvomno povzroči veliko porabo energije, še posebej, če je nehotena in jo povzroči nenaden in močan čustveni impulz.
Ko govorimo o koncentraciji, moramo pomisliti tudi na problem človekove nezmožnosti, da bi osvobodil svoj um določenih misli, čustev, izkušenj ali občutkov iz daljne ali bližnje preteklosti. Na primer, vsak kompleks je nezmožnost osvoboditve čustvenega šoka preteklosti, ki jo oseba šteje za del sedanjosti.
Lahko rečemo, da koncentracija ne povzroča utrujenosti, ampak predstavlja mentalni tonus, ki bi moral biti za človeka normalen. Tavanje misli je hipotonija misli, ne spodbuja počitka ali zmanjšanja porabe energije, ampak povzroča upad energije. Potepanje domišljije ne prispeva k počitku uma, ampak, nasprotno, povečuje število dražljajev v človekovem umu, od katerih vsak zase ustvarja drug problem, ki zahteva svojo rešitev.
Edini resnično učinkovit počitek za um prihaja iz stanja, ki ga lahko dosežemo tako, da se naučimo popolnoma osvoboditi svoj um misli, to je stanje »duševnega vakuuma«, ko se tok misli začasno ustavi. To stanje lahko opredelimo kot popolno »dekoncentracijo«. Tehnika doseganja mentalne koncentracije je vedno odvisna od tega, ali je bil dosežen poseben čustveni in voljni položaj, v katerem oseba pripisuje izključni, izključni pomen dejavnosti, predmetu ali ideji, na katero se želi osredotočiti. To je stanje popolne brezbrižnosti osebe do vsega, kar ni predmet njegovega zanimanja. Ključni dejavnik v tehniki koncentracije je brezbrižnost do drugih dražljajev in idej, ki temelji na voljnem naporu. Omeniti moramo še en zelo pomemben dejavnik: ko se človek pravilno koncentrira, živi v sedanjosti (glej poglavje »Resnična in namišljena eksistenca«).
Da bi pravilno ovrednotili mehanizem koncentracije, navedimo en primer: človek se veliko lažje koncentrira, če mora to storiti, ko obstaja močna zunanja prisila, ki ga sili, da dokonča delo ali reši neko težavo v določenem času. okvir. Proces koncentracije bo še lažji, če ga čaka kazen, ker naloge ni opravil pravočasno.
Ko se človek želi na nekaj osredotočiti, mora temu, na kar bo usmeril svojo pozornost, dati največjo pomembnost. Misliti mora, da je zanj zelo pomembno, da posveti izključno pozornost temi, ki ga zanima, in da je to »vprašanje življenja ali smrti«. Naslednja stvar, ki si jo morate zapomniti, je pravilna uporaba dihanja. Potrebno je globoko vdihniti, da z močjo volje dosežemo koncentracijo celotne psihofizične strukture. Da bi ohranili koncentracijo, morate popraviti svojo pozornost, kar lahko dosežete z višjo stopnjo prebujenosti. Stanje koncentracije pravzaprav predstavlja višjo stopnjo budnosti uma. Nasprotno pa je nezmožnost koncentracije vedno posledica spanja uma, torej nizke stopnje zavesti. Za učinkovito koncentracijo se morate izogibati dolgočasju in duševnemu spancu ter vsako idejo, nalogo ali predmet dojemati, kot da se z njimi srečujete prvič v življenju.
Enciklopedični YouTube
1 / 5
✪ Naloge koncentracije
✪ Normalna koncentracija raztopine. Normalnost (SN). Reševanje problema.
✪ Koncentracija. Košpalar
✪ Naloga 22 Naloga koncentracije
✪ Kemija. Koncentracija snovi. Spletni učni center Foxford
Podnapisi
Masni delež
Masni delež komponente je razmerje med maso dane komponente in vsoto mas vseh komponent. Po priporočilih IUPAC je označen s simbolom w (\displaystyle w), v literaturi v ruskem jeziku je oznaka pogostejša ω (\displaystyle \omega ). Masni delež je brezdimenzijska količina, običajno izražena v delih enote ali v odstotkih (če želite izraziti masni delež v odstotkih, pomnožite navedeni izraz s 100%):
ω B = m B m (\displaystyle \omega _(\mathrm (B) )=(\frac (m_(\mathrm (B) ))(m)))V binarnih raztopinah pogosto obstaja nedvoumna (funkcionalna) povezava med gostoto raztopine in njeno koncentracijo (pri dani temperaturi). Tako je mogoče v praksi določiti koncentracije pomembnih raztopin z denzimetrom (alkohometer, saharimeter, laktometer). Nekateri hidrometri niso kalibrirani v vrednostih gostote, temveč neposredno v koncentraciji raztopine (alkohol, maščoba v mleku, sladkor). Upoštevati je treba, da ima pri nekaterih snoveh krivulja gostote raztopine največ, v tem primeru se izvedeta dve meritvi: neposredno in z rahlim redčenjem raztopine.
Pogosto se za izražanje koncentracije (na primer žveplove kisline v elektrolitu akumulatorskih baterij) uporablja preprosto njihova gostota. Pogosti so hidrometri (denzimetri, denzimetri), namenjeni določanju koncentracije raztopin snovi.
Volumski delež
Volumski delež komponente je razmerje med prostornino komponente in vsoto prostornin komponent pred mešanjem. Volumski delež se meri v delih enote ali v odstotkih.
ϕ B = V B ∑ V i (\displaystyle \phi _(\mathrm (B) )=(\frac (V_(\mathrm (B) ))(\sum V_(i)))),Pri mešanju tekočin se lahko njihova skupna prostornina zmanjša, zato vsote volumnov komponent ne zamenjajte z volumnom mešanice.
Kot je navedeno zgoraj, obstajajo hidrometri, namenjeni določanju koncentracije raztopin določenih snovi. Takšni hidrometri niso kalibrirani v vrednostih gostote, temveč neposredno v koncentraciji raztopine. Za običajne raztopine etilnega alkohola, katerih koncentracija je običajno izražena v volumskih odstotkih, se takšni hidrometri imenujejo alkoholometri ali andrometri.
Molarnost (molska volumska koncentracija)
Molarna koncentracija (molarnost, molarnost) - količina snovi (število molov) komponente na prostorninsko enoto zmesi. Molarno koncentracijo v sistemu SI merimo v mol/m³, v praksi pa jo veliko pogosteje izražamo v mol/l ali mmol/l. Uporablja se tudi izraz "v molarnosti". Možno je tudi drugo poimenovanje molske koncentracije, ki se običajno označuje z M. Tako se raztopina s koncentracijo 0,5 mol/l imenuje 0,5 molska, piše pa se »0,5 M«.
Opomba: Za številom pišejo »mol«, tako kot za številom pišejo »cm«, »kg« itd., ne da bi sklanjali velike in male črke.
c B = n B V (\displaystyle (c_(\mathrm (B) ))=(\frac (n_(\mathrm (B) ))(V))),Normalna koncentracija (ekvivalent molske koncentracije, « normalnost»)
Normalna koncentracija je število ekvivalentov določene snovi v 1 litru mešanice. Normalna koncentracija je izražena v mol-eq/l ali g-eq/l (kar pomeni molske ekvivalente). Za zapis koncentracije takšnih raztopin so okrajšave " n" ali " n" Na primer, raztopina, ki vsebuje 0,1 mol-eq/l, se imenuje decinormalna in jo zapišemo kot 0,1 n.
c (f e q B) = c ((1 / z) B) = z ⋅ c B = z ⋅ n B V = 1 f e q ⋅ n B V (\displaystyle c(f_(eq)~\mathrm (B))=c( \big ()(1/z)~\mathrm (B) (\big))=z\cdot c_(\mathrm (B) )=z\cdot (\frac (n_(\mathrm (B) ))( V))=(\frac (1)(f_(eq)))\cdot (\frac (n_(\mathrm (B) ))(V))),Normalna koncentracija se lahko razlikuje glede na reakcijo, v kateri je snov udeležena. Na primer, enomolarna raztopina H 2 SO 4 bo enonormalna, če naj bi reagirala z alkalijo, da nastane kalijev hidrogensulfat KHSO 4, in dvonormalna v reakciji, da nastane K 2 SO 4 .
Molnaya (molar) deliti
Molski delež je razmerje med številom molov dane komponente in skupnim številom molov vseh komponent. Molski delež je izražen v delih enote. IUPAC priporoča označevanje molskega deleža s črko x (\displaystyle x)(in za pline - y (\displaystyle y)), tudi v literaturi obstajajo oznake χ (\displaystyle \chi ), X (\displaystyle X).
x B = n B ∑ n i (\displaystyle x_(\mathrm (B) )=(\frac (n_(\mathrm (B) ))(\sum n_(i)))),Molsko frakcijo je mogoče uporabiti na primer za količinsko opredelitev ravni onesnaževal v zraku in je pogosto izražena v delcih na milijon (ppm). Vendar je treba, tako kot pri drugih brezdimenzionalnih količinah, v izogib zmedi navesti količino, na katero se navedena vrednost nanaša.
Molalnost (koncentracija molske mase, molalna koncentracija)
Molska koncentracija (molnost, koncentracija molske mase) - količina topljenca (število molov) v 1000 g topila. Izraz "molalnost", merjen v molih na kg, je prav tako pogost. Torej, raztopina s koncentracijo 0,5 mol/kg klical 0,5 mola.
m B = n B m A (\displaystyle (m_(\mathrm (B) ))=(\frac (n_(\mathrm (B) ))(m_(\mathrm (A) )))),Posebno pozornost je treba nameniti dejstvu, da sta molska koncentracija in molalnost kljub podobnosti imen različni količini. Prvič, v nasprotju z molsko koncentracijo pri izražanju koncentracije v molalnosti izračun temelji na masi topilo, in ne glede na prostornino raztopine. Molalnost za razliko od molske koncentracije ni odvisna od temperature.
Masna koncentracija (titer)
Masna koncentracija je razmerje med maso topljenca in prostornino raztopine. Po priporočilih IUPAC je označen s simbolom γ (\displaystyle \gamma ) oz ρ (\displaystyle \rho ) .
ρ B = m B V (\displaystyle \rho _(\mathrm (B) )=(\frac (m_(\mathrm (B) ))(V))).Formule za prehod iz enega izraza koncentracije v drugega
Odvisno od izbrane formule se napaka pretvorbe giblje od nič do nekaj decimalnih mest.
Od masnega deleža do molarnosti
c B = ρ ⋅ ω B M (B) (\displaystyle c_(\mathrm (B) )=(\frac (\rho \cdot \omega _(\mathrm (B) ))(M(\mathrm (B)) ))),Če je gostota raztopine izražena v g/ml in molska masa v g/mol, je treba za izražanje odgovora v mol/L izraz pomnožiti s 1000 ml/L. Če je masni delež izražen v odstotkih, je treba tudi izraz deliti s 100 %.