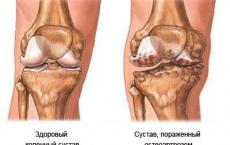
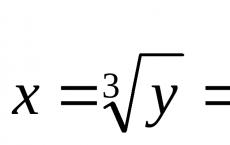Soli koje formiraju okside. Kiseli oksidi
Danas počinjemo naše upoznavanje sa najvažnijim klasama neorganskih jedinjenja. Anorganske tvari dijele se prema svom sastavu, kao što već znate, na jednostavne i složene.
|
OXIDE |
ACID |
BASE |
SALT |
|
E x O y |
NnA A – kiseli ostatak |
ja(OH)b OH – hidroksilna grupa |
Me n A b |
Složene neorganske tvari dijele se u četiri klase: oksidi, kiseline, baze, soli. Počinjemo s klasom oksida.
OXIDES
Oksidi
- to su složene supstance koje se sastoje od dva hemijski elementi, od kojih je jedan kiseonik, sa valencijom 2. Samo jedan hemijski element - fluor, kada se spoji sa kiseonikom, ne formira oksid, već kiseonik fluorid OF 2.
Oni se jednostavno zovu “oksid + naziv elementa” (vidi tabelu). Ako je valencija hemijskog elementa promenljiva, ona se označava rimskim brojem u zagradi iza naziva hemijskog elementa.
|
Formula |
Ime |
Formula |
Ime |
|
ugljen(II) monoksid |
Fe2O3 |
gvožđe(III) oksid |
|
|
dušikov oksid (II) |
CrO3 |
hrom(VI) oksid |
|
|
Al2O3 |
aluminijum oksid |
cink oksid |
|
|
N2O5 |
dušikov oksid (V) |
Mn2O7 |
mangan(VII) oksid |
Klasifikacija oksida
Svi oksidi se mogu podijeliti u dvije grupe: koji stvaraju soli (bazni, kiseli, amfoterni) i koji ne stvaraju soli ili indiferentni.
|
Metalni oksidi Krzno x O y |
Oksidi nemetala neMe x O y |
|||
|
Basic |
Kisela |
Amfoterično |
Kisela |
Ravnodušni |
|
I, II Meh |
V-VII Ja |
ZnO,BeO,Al 2 O 3, Fe 2 O 3 , Cr 2 O 3 |
> II neMe |
I, II neMe CO, NE, N2O |
1). Osnovni oksidi su oksidi koji odgovaraju bazama. Glavni oksidi su oksidi metali 1 i 2 grupe, kao i metali bočne podgrupe sa valentnošću I I II (osim ZnO - cink oksida i BeO – berilijev oksid):

2). Kiseli oksidi su oksidi, koji odgovaraju kiselinama. Kiseli oksidi su oksidi nemetala (osim onih koji ne stvaraju sol - indiferentan), kao i metalni oksidi bočne podgrupe sa valentnošću od V prije VII (Na primjer, CrO 3 je hrom (VI) oksid, Mn 2 O 7 je mangan (VII) oksid):

3). Amfoterni oksidi su oksidi, koji odgovaraju bazama i kiselinama. To uključuje metalni oksidi glavne i sekundarne podgrupe sa valentnošću III , Ponekad IV , kao i cink i berilijum (npr. BeO, ZnO, Al 2 O 3, Cr 2 O 3).
4). Oksidi koji ne stvaraju soli su oksidi koji su indiferentni prema kiselinama i bazama. To uključuje oksidi nemetala sa valentnošću I I II (Na primjer, N 2 O, NO, CO).
Zaključak: priroda svojstava oksida prvenstveno zavisi od valencije elementa.
Na primjer, krom oksidi:
CrO(II- glavni);
Cr 2 O 3 (III- amfoterni);
CrO3(VII- kiselo).
Klasifikacija oksida
(prema rastvorljivosti u vodi)
|
Kiseli oksidi |
Osnovni oksidi |
Amfoterni oksidi |
|
Rastvorljivo u vodi. Izuzetak – SiO 2 (nije rastvorljivo u vodi) |
U vodi se otapaju samo oksidi alkalnih i zemnoalkalnih metala (ovo su metali I "A" i II "A" grupe, izuzetak Be, Mg) |
Ne stupaju u interakciju sa vodom. Nerastvorljivo u vodi |
Dovršite zadatke:
1. Zapišite ga zasebno hemijske formule kiseli i bazični oksidi koji stvaraju soli.
NaOH, AlCl 3, K 2 O, H 2 SO 4, SO 3, P 2 O 5, HNO 3, CaO, CO.
2. Date supstance : CaO, NaOH, CO 2, H 2 SO 3, CaCl 2, FeCl 3, Zn(OH) 2, N 2 O 5, Al 2 O 3, Ca(OH) 2, CO 2, N 2 O, FeO,
SO 3, Na 2 SO 4, ZnO, CaCO 3, Mn 2 O 7, CuO, KOH, CO, Fe(OH) 3
Dobivanje oksida
Simulator "Interakcija kiseonika sa jednostavnim supstancama"
|
1. Sagorijevanje tvari (oksidacija kisikom) |
Sprava za obuku |
2Mg +O 2 =2MgO |
|
b) složene supstance |
2H 2 S+3O 2 =2H 2 O+2SO 2 |
|
|
2. Razgradnja složenih supstanci (koristite tabelu kiselina, pogledajte dodatke) |
a) soli SALTt= BAZNI OKSID+KISELI OKSID |
CaCO 3 = CaO + CO 2 |
|
b) Nerastvorljive baze ja(OH)bt= Me x O y+ H 2 O |
Cu(OH)2t=CuO+H2O |
|
|
c) kiseline koje sadrže kiseonik NnA=ACID OXIDE + H 2 O |
H 2 SO 3 =H 2 O+SO 2 |
Fizička svojstva oksida
Na sobnoj temperaturi većina oksida su čvrste materije (CaO, Fe 2 O 3 itd.), neke su tečnosti (H 2 O, Cl 2 O 7 itd.) i gasovi (NO, SO 2 itd.).



Hemijska svojstva oksida
|
HEMIJSKA SVOJSTVA BAZIČNIH OKSIDA 1. Osnovni oksid + Kiseli oksid = So (r. spojevi) CaO + SO 2 = CaSO 3 2. Bazni oksid + kiselina = so + H 2 O (izmjenski rastvor) 3 K 2 O + 2 H 3 PO 4 = 2 K 3 PO 4 + 3 H 2 O 3. Osnovni oksid + voda = alkalija (spoji) Na 2 O + H 2 O = 2 NaOH |
|
HEMIJSKA SVOJSTVA KISELNIH OKSIDA 1. Kiseli oksid + voda = kiselina (r. spojevi) CO 2 + H 2 O = H 2 CO 3, SiO 2 – ne reaguje 2. Kiseli oksid + baza = sol + H 2 O (razmjenski kurs) P 2 O 5 + 6 KOH = 2 K 3 PO 4 + 3 H 2 O 3. Osnovni oksid + Kiseli oksid = So (r. spojevi) CaO + SO 2 = CaSO 3 4. Manje hlapljivi istiskuju više isparljive iz svojih soli CaCO 3 + SiO 2 = CaSiO 3 + CO 2 |
|
HEMIJSKA SVOJSTVA AMFOTERNIH OKSIDA U interakciji su i sa kiselinama i sa alkalijama. ZnO + 2 HCl = ZnCl 2 + H 2 O ZnO + 2 NaOH + H 2 O = Na 2 [Zn (OH) 4] (u rastvoru) ZnO + 2 NaOH = Na 2 ZnO 2 + H 2 O (kada je spojen) |
Primjena oksida
Neki oksidi su nerastvorljivi u vodi, ali mnogi reaguju s vodom i formiraju jedinjenja:
SO 3 + H 2 O = H 2 SO 4
CaO + H 2 O = Ca( Oh) 2
Rezultat su često vrlo potrebna i korisna jedinjenja. Na primjer, H 2 SO 4 – sumporna kiselina, Ca(OH) 2 – gašeno vapno itd.
Ako su oksidi netopivi u vodi, onda ljudi vješto koriste ovo svojstvo. Na primjer, cink oksid ZnO je supstanca bijela, stoga se koristi za pripremu bijele uljane boje (cink bijele). Budući da je ZnO praktički netopiv u vodi, bilo koja površina može se farbati cink bijelom bojom, uključujući i one koje su izložene padavinama. Netopljivost i netoksičnost omogućavaju da se ovaj oksid koristi u proizvodnji kozmetičkih krema i pudera. Farmaceuti ga prave u adstringentni i prašak za sušenje za vanjsku upotrebu.
Isto vrijedne nekretnine posjeduje titanijum oksid (IV) – TiO 2. Takođe ima prelepu belu boju i koristi se za pravljenje titanijum bele boje. TiO 2 je nerastvorljiv ne samo u vodi, već i u kiselinama, pa su premazi napravljeni od ovog oksida posebno stabilni. Ovaj oksid se dodaje u plastiku kako bi joj dao bijelu boju. Ulazi u sastav emajla za metalno i keramičko posuđe.
Krom (III) oksid - Cr 2 O 3 - vrlo jaki tamnozeleni kristali, nerastvorljivi u vodi. Cr 2 O 3 se koristi kao pigment (boja) u proizvodnji ukrasnog zelenog stakla i keramike. Poznata GOI pasta (skraćeno od naziva “Državni optički institut”) koristi se za brušenje i poliranje optike, metala. proizvoda, u nakitu.
Zbog nerastvorljivosti i čvrstoće hrom (III) oksida, koristi se i u štamparskim bojama (npr. za bojenje novčanica). Općenito, oksidi mnogih metala se koriste kao pigmenti za širok spektar boja, iako je to daleko od njihove jedine primjene.
Zadaci za konsolidaciju
1. Napišite odvojeno hemijske formule kiselih i bazičnih oksida koji stvaraju soli.
NaOH, AlCl 3, K 2 O, H 2 SO 4, SO 3, P 2 O 5, HNO 3, CaO, CO.
2. Date supstance : CaO, NaOH, CO 2, H 2 SO 3, CaCl 2, FeCl 3, Zn(OH) 2, N 2 O 5, Al 2 O 3, Ca(OH) 2, CO 2, N 2 O, FeO, SO 3, Na 2 SO 4, ZnO, CaCO 3, Mn 2 O 7, CuO, KOH, CO, Fe(OH) 3
Odaberite sa liste: bazični oksidi, kiseli oksidi, indiferentni oksidi, amfoterni oksidi i dajte im imena.
3. Popunite CSR, navedite vrstu reakcije, navedite produkte reakcije
Na 2 O + H 2 O =
N 2 O 5 + H 2 O =
CaO + HNO3 =
NaOH + P2O5 =
K 2 O + CO 2 =
Cu(OH) 2 = ? + ?
4. Izvršite transformacije prema shemi:
1) K → K 2 O → KOH → K 2 SO 4
2) S→SO 2 →H 2 SO 3 →Na 2 SO 3
3) P→P 2 O 5 →H 3 PO 4 →K 3 PO 4
U prirodi postoje tri klase neorganskih hemijskih jedinjenja: soli, hidroksidi i oksidi. Prvi su spojevi atoma metala s kiselinskim ostatkom, na primjer, CI-. Potonje se dijele na kiseline i baze. Molekuli prvog od njih sastoje se od H+ kationa i kiselinskog ostatka, na primjer, SO 4 -. Baze sadrže metalni kation, na primjer, K+, i anjon u obliku hidroksilne grupe OH-. A oksidi se, ovisno o svojim svojstvima, dijele na kisele i bazične. O potonjem ćemo govoriti u ovom članku.
Definicija
Osnovni oksidi su tvari koje se sastoje od dva kemijska elementa, od kojih je jedan nužno kisik, a drugi metal. Kada se supstancama ove vrste doda voda, nastaju baze.
Hemijska svojstva osnovnih oksida
Supstance ove klase su prvenstveno sposobne da reaguju sa vodom, usled čega se dobija baza. Na primjer, možemo dati sljedeću jednačinu: CaO + H 2 O = Ca(OH) 2.
Reakcije sa kiselinama
Ako se bazični oksidi pomiješaju s kiselinama, mogu se dobiti soli i voda. Na primjer, ako dodate hloridnu kiselinu u kalijev oksid, dobićete kalijum hlorid i vodu. Jednačina reakcije će izgledati ovako: K 2 O + 2 HCI = 2 KSI + H 2 O.

Interakcija sa kiselim oksidima
Ove vrste hemijskih reakcija dovode do stvaranja soli. Na primjer, ako dodate ugljični dioksid u kalcijev oksid, dobićete kalcijum karbonat. Ova reakcija se može izraziti u obliku sljedeće jednačine: CaO + CO 2 = CaCO 3. Ova vrsta hemijske interakcije može se desiti samo pod uticajem visoke temperature.
Amfoterni i bazični oksidi
Ove tvari također mogu međusobno komunicirati. To se događa zato što prvi imaju svojstva i kiselih i bazičnih oksida. Kao rezultat takvog hemijske interakcije nastaju kompleksne soli. Kao primjer, dajemo jednadžbu za reakciju koja se javlja kada se kalijev oksid (bazni) pomiješa s aluminij oksidom (amfoterni): K 2 O + AI 2 O 3 = 2KAIO 2. Dobivena supstanca naziva se kalijum aluminat. Ako pomiješate iste reagense, ali i dodate vodu, reakcija će se odvijati na sljedeći način: K 2 O + AI 2 O 3 + 4H 2 O = 2K. Tvar koja nastaje naziva se kalijum tetrahidroksoaluminat.
Fizička svojstva
Različiti bazični oksidi se međusobno uvelike razlikuju po fizičkim svojstvima, ali svi su, u osnovi, u normalnim uslovima u čvrstom agregacijskom stanju i imaju visoku tačku topljenja.

Pogledajmo svako hemijsko jedinjenje pojedinačno. Kalijev oksid se pojavljuje kao svijetložuta krutina. Topi se na temperaturi od +740 stepeni Celzijusa. Natrijum oksid je bezbojni kristal. Pretvaraju se u tečnost na temperaturi od +1132 stepena. Kalcijum oksid je predstavljen bijelim kristalima koji se tope na +2570 stepeni. Gvozdeni dioksid se pojavljuje kao crni prah. Na temperaturi od +1377 stepeni Celzijusa poprima tečno stanje. Magnezijev oksid je sličan spoju kalcija - također je bijeli kristal. Topi se na +2825 stepeni. Litijum oksid je prozirni kristal sa tačkom topljenja od +1570 stepeni. Ova tvar je vrlo higroskopna. Barijum oksid izgleda isto kao i prethodni hemijski spoj, temperatura na kojoj poprima tečno stanje je nešto viša - +1920 stepeni. Živin oksid je narandžasto-crveni prah. Na temperaturi od +500 stepeni Celzijusa ovo Hemijska supstanca razgrađuje. Kromov oksid je tamnocrveni prah sa istom tačkom topljenja kao i jedinjenje litija. Cezijev oksid ima istu boju kao živa. Razlaže se kada je izložen sunčevoj energiji. Nikl oksid su zeleni kristali koji se pretvaraju u tečnost na temperaturi od +1682 stepena Celzijusa. Kao što možete vidjeti, fizička svojstva sve supstance u ovoj grupi imaju mnogo opšte karakteristike, iako imaju neke razlike. Kuprum (bakar) oksid izgleda kao crni kristali. Prelazi u tečno agregatno stanje na temperaturi od +1447 stepeni Celzijusa.

Kako se te hemikalije dobijaju?
Bazni oksidi se mogu proizvesti reakcijom metala s kisikom na visokoj temperaturi. Jednačina za ovu interakciju je sljedeća: 4K + O 2 = 2K 2 O. Drugi način dobijanja hemijskih jedinjenja ove klase je razlaganje nerastvorljive baze. Jednačina se može napisati na sljedeći način: Ca(OH) 2 = CaO + H 2 O. Za izvođenje ove vrste reakcije potrebni su posebni uslovi u obliku visoke temperature. Osim toga, pri razgradnji određenih soli nastaju i bazični oksidi. Primjer je sljedeća jednadžba: CaCO 3 \u003d CaO + CO 2. Tako je nastao i kiseli oksid.
Upotreba bazičnih oksida

Hemijska jedinjenja ove grupe se široko koriste u raznim industrijama. Zatim ćemo razmotriti upotrebu svakog od njih. Aluminij oksid se koristi u stomatologiji za izradu proteza. Koristi se i u proizvodnji keramike. Kalcijum oksid je jedna od komponenti uključenih u proizvodnju pješčano-krečne opeke. Može djelovati i kao materijal otporan na vatru. U prehrambenoj industriji ovo je aditiv E529. Kalijum oksid je jedan od sastojaka mineralnih đubriva za biljke, natrijum se koristi u hemijska industrija, uglavnom u proizvodnji hidroksida istog metala. Magnezijum oksid se takođe koristi u prehrambenoj industriji kao aditiv pod brojem E530. Osim toga, lijek je protiv povećane kiselosti želudačnog soka. Barijum oksid se koristi u hemijskim reakcijama kao katalizator. Gvozdeni dioksid se koristi u proizvodnji livenog gvožđa, keramike i boja. To je i boja za hranu broj E172. Nikl oksid daje staklu zelenu boju. Osim toga, koristi se u sintezi soli i katalizatora. Litijum oksid je jedna od komponenti u proizvodnji nekih vrsta stakla, povećava čvrstoću materijala. Jedinjenje cezija djeluje kao katalizator za određene kemijske reakcije. Oksid bakra, kao i neki drugi, svoju primjenu nalazi u proizvodnji posebnih vrsta stakla, kao i za proizvodnju čistog bakra. U proizvodnji boja i emajla koristi se kao pigment koji daje plavu boju.
Supstance ove klase u prirodi
IN prirodno okruženje hemijska jedinjenja ove grupe nalaze se u obliku minerala. To su uglavnom kiseli oksidi, ali se javljaju i među ostalima. Na primjer, spoj aluminija je korund.

U zavisnosti od nečistoća prisutnih u njemu, može biti različitih boja. Među varijacijama zasnovanim na AI 2 O 3 mogu se razlikovati rubin koji ima crvenu boju i safir, mineral koji ima plavu boju. Ista hemikalija se također može naći u prirodi u obliku glinice. Spoj bakra sa kiseonikom se u prirodi javlja u obliku minerala tenorit.
Zaključak
Kao zaključak možemo reći da sve supstance o kojima se govori u ovom članku imaju slična fizička i slična hemijska svojstva. Svoju primenu nalaze u mnogim industrijama - od farmaceutske do prehrambene.
Oksidi.
To su složene supstance koje se sastoje od DVA elementa, od kojih je jedan kiseonik. Na primjer:
CuO – bakar(II) oksid
AI 2 O 3 – aluminijum oksid
SO 3 – sumporov oksid (VI)
Oksidi se dijele (klasificiraju) u 4 grupe:
Na 2 O– Natrijum oksid
CaO – kalcijum oksid
Fe 2 O 3 – gvožđe (III) oksid
2). Kisela– Ovo su oksidi nemetali. A ponekad i metali ako je oksidacijsko stanje metala > 4. Na primjer:
CO 2 – Ugljen monoksid (IV)
P 2 O 5 – Fosfor (V) oksid
SO 3 – sumporov oksid (VI)
3). Amfoterično– To su oksidi koji imaju svojstva i bazičnih i kiselih oksida. Morate znati pet najčešćih amfoternih oksida:
BeO–berilijev oksid
ZnO–cink oksid
AI 2 O 3 – Aluminijum oksid
Cr 2 O 3 – Krom (III) oksid
Fe 2 O 3 – Gvožđe (III) oksid
4). Ne stvara soli (indiferentan)– To su oksidi koji ne pokazuju svojstva ni bazičnih ni kiselih oksida. Treba zapamtiti tri oksida:
CO – ugljen monoksid (II) ugljen monoksid
NO – dušikov oksid (II)
N 2 O – azot oksid (I) gas za smejanje, azot oksid
Metode za proizvodnju oksida.
1). Sagorevanje, tj. interakcija s kisikom jednostavne tvari:
4Na + O 2 = 2Na 2 O
4P + 5O 2 = 2P 2 O 5
2). Sagorevanje, tj. interakcija s kisikom složene tvari (sastoji se od dva elementa) tako se formira dva oksida.
2ZnS + 3O 2 = 2ZnO + 2SO 2
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2
3). Raspadanje tri slabe kiseline. Drugi se ne raspadaju. U tom slučaju nastaju kiseli oksid i voda.
H 2 CO 3 = H 2 O + CO 2
H 2 SO 3 = H 2 O + SO 2
H 2 SiO 3 = H 2 O + SiO 2
4). Raspadanje nerastvorljiv osnove. Nastaju osnovni oksid i voda.
Mg(OH) 2 = MgO + H 2 O
2Al(OH) 3 = Al 2 O 3 + 3H 2 O
5). Raspadanje nerastvorljiv soli Nastaju bazični oksid i kiseli oksid.
CaCO 3 = CaO + CO 2
MgSO 3 = MgO + SO 2
Hemijska svojstva.
I. Osnovni oksidi.
alkali.
Na 2 O + H 2 O = 2NaOH
CaO + H 2 O = Ca(OH) 2
SuO + H 2 O = reakcija ne dolazi, jer moguća baza koja sadrži bakar - nerastvorljiva
2). Interakcija sa kiselinama, što rezultira stvaranjem soli i vode. (Bazni oksid i kiseline UVIJEK reagiraju)
K2O + 2HCI = 2KCl + H2O
CaO + 2HNO 3 = Ca(NO 3) 2 + H 2 O
3). Interakcija s kiselim oksidima, što rezultira stvaranjem soli.
Li 2 O + CO 2 = Li 2 CO 3
3MgO + P 2 O 5 = Mg 3 (PO 4) 2
4). Interakcija sa vodonikom proizvodi metal i vodu.
CuO + H 2 = Cu + H 2 O
Fe 2 O 3 + 3H 2 \u003d 2Fe + 3H 2 O
II.Kiseli oksidi.
1). Trebalo bi doći do interakcije s vodom kiselina.(SamoSiO 2 ne stupa u interakciju sa vodom)
CO 2 + H 2 O = H 2 CO 3
P 2 O 5 + 3H 2 O = 2H 3 PO 4
2). Interakcija sa rastvorljivim bazama (alkalijama). Ovo proizvodi sol i vodu.
SO 3 + 2KOH = K 2 SO 4 + H 2 O
N 2 O 5 + 2KOH = 2KNO 3 + H 2 O
3). Interakcija sa bazičnim oksidima. U tom slučaju nastaje samo sol.
N 2 O 5 + K 2 O = 2KNO 3
Al 2 O 3 + 3SO 3 \u003d Al 2 (SO 4) 3
Osnovne vježbe.
1). Dopunite jednadžbu reakcije. Odredite njen tip.
K 2 O + P 2 O 5 =
Rješenje.
Da bismo zapisali šta nastaje kao rezultat, potrebno je utvrditi koje su tvari reagirale - ovdje je to kalijev oksid (bazni) i fosforov oksid (kiseli) prema svojstvima - rezultat bi trebao biti SOL (vidi svojstvo br. 3) a sol se sastoji od atoma metala (u našem slučaju kalijuma) i kiselog ostatka koji uključuje fosfor (tj. PO 4 -3 - fosfat) Stoga
3K 2 O + P 2 O 5 = 2K 3 RO 4
vrsta reakcije - spoj (jer dvije supstance reaguju, a jedna nastaje)
2). Izvršiti transformacije (lanac).
Ca → CaO → Ca(OH) 2 → CaCO 3 → CaO
Rješenje
Da biste dovršili ovu vježbu, morate zapamtiti da je svaka strelica jedna jednačina (jedan hemijska reakcija). Označimo svaku strelicu. Stoga je potrebno zapisati 4 jednačine. Tvar napisana lijevo od strelice (početna tvar) ulazi u reakciju, a supstanca napisana desno nastaje kao rezultat reakcije (proizvod reakcije). Hajde da dešifrujemo prvi deo snimka:
Ca + ... .. → CaO Obratite pažnju da prosta supstanca reaguje i nastaje oksid. Poznavajući metode za dobijanje oksida (br. 1), dolazimo do zaključka da je u ovoj reakciji potrebno dodati -kiseonik (O 2)
2Ca + O 2 → 2CaO
Pređimo na transformaciju br. 2
CaO → Ca(OH) 2
CaO + ……→ Ca(OH) 2
Dolazimo do zaključka da je ovdje potrebno primijeniti svojstvo bazičnih oksida - interakciju sa vodom, jer samo u ovom slučaju iz oksida se formira baza.
CaO + H 2 O → Ca(OH) 2
Pređimo na transformaciju br. 3
Ca(OH) 2 → CaCO 3
Ca(OH) 2 + ….. = CaCO 3 + …….
Dolazimo do zaključka da ovdje mi pričamo o ugljičnom dioksidu CO 2 jer samo kada je u interakciji sa alkalijama formira sol (vidi svojstvo br. 2 kiselih oksida)
Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O
Pređimo na transformaciju br. 4
CaCO 3 → CaO
CaCO 3 = ….. CaO + ……
Dolazimo do zaključka da se ovdje stvara više CO 2, jer CaCO 3 je nerastvorljiva so i prilikom razgradnje takvih supstanci nastaju oksidi.
CaCO 3 = CaO + CO 2
3). S kojom od sljedećih supstanci CO 2 stupa u interakciju? Napišite jednačine reakcije.
A). Hlorovodonična kiselina B). Natrijum hidroksid B). Kalijum oksid d). Voda
D). Vodonik E). Sumpor(IV) oksid.
Utvrdili smo da je CO 2 kiseli oksid. A kiseli oksidi reaguju sa vodom, alkalijama i bazičnim oksidima... Dakle, sa date liste biramo odgovore B, C, D i sa njima zapisujemo jednadžbe reakcije:
1). CO 2 + 2NaOH = Na 2 CO 3 + H 2 O
2). CO 2 + K 2 O = K 2 CO 3
Oksidi- to su složena neorganska jedinjenja koja se sastoje od dva elementa, od kojih je jedan kiseonik (u oksidacionom stanju -2).
Na primjer, Na 2 O, B 2 O 3, Cl 2 O 7 su oksidi. Sve ove tvari sadrže kisik i još jedan element. Supstance Na 2 O 2 , H 2 SO 4 i HCl nisu oksidi: u prvom je oksidaciono stanje kiseonika -1, u drugom nisu dva, već tri elementa, a treći ne sadrži kiseonik uopšte.
Ako ne razumijete značenje pojma "oksidacijsko stanje", u redu je. Prvo, možete pogledati relevantni članak na ovoj stranici. Drugo, čak i bez razumijevanja ovog pojma, možete nastaviti čitati. Možete privremeno zaboraviti spomenuti stanje oksidacije.
Dobijeni su oksidi gotovo svih trenutno poznatih elemenata, osim nekih plemenitih plinova i “egzotičnih” transuranskih elemenata. Štoviše, mnogi elementi formiraju nekoliko oksida (za dušik, na primjer, poznato je šest).
Nomenklatura oksida
Moramo naučiti da imenujemo okside. Vrlo je jednostavno.Primjer 1. Imenujte sljedeća jedinjenja: Li 2 O, Al 2 O 3, N 2 O 5, N 2 O 3.
Li 2 O - litijum oksid,
Al 2 O 3 - aluminijum oksid,
N 2 O 5 - dušikov oksid (V),
N 2 O 3 - dušikov oksid (III).
Imajte na umu važnu točku: ako je valencija elementa konstantna, NE spominjemo je u nazivu oksida. Ako se valencija promijeni, obavezno je naznačite u zagradi! Litijum i aluminijum imaju konstantna valencija, dušik ima promjenjivu valencu; Iz tog razloga su nazivi dušikovih oksida dopunjeni rimskim brojevima koji simboliziraju valenciju.
Vježba 1. Imenujte okside: Na 2 O, P 2 O 3, BaO, V 2 O 5, Fe 2 O 3, GeO 2, Rb 2 O. Ne zaboravite da postoje elementi sa konstantnom i promjenljivom valentnošću.
Još jedna važna stvar: ispravnije je tvar F 2 O nazvati ne "fluorov oksid", već "oksigen fluorid"!
Fizička svojstva oksida
Fizička svojstva su veoma raznolika. To je posebno zbog činjenice da se oksidi mogu eksponirati različite vrste hemijska veza. Tačke topljenja i ključanja uvelike variraju. U normalnim uslovima oksidi mogu biti u čvrstom stanju (CaO, Fe 2 O 3, SiO 2, B 2 O 3), tečnom stanju (N 2 O 3, H 2 O), u obliku gasova (N 2 O , SO 2, NO, CO).
Boja je raznolika: MgO i Na 2 O su bijele, CuO je crna, N 2 O 3 je plava, CrO 3 je crvena, itd.
Oksidne taline s ionskim tipom veze dobro provode struju, kovalentni oksidi u pravilu imaju nisku električnu vodljivost.
Klasifikacija oksida
Svi prirodni oksidi mogu se podijeliti u 4 klase: bazični, kiseli, amfoterni i koji ne stvaraju soli. Ponekad se prve tri klase kombinuju u grupu oksida koji stvaraju soli, ali za nas to sada nije bitno. Hemijska svojstva oksida iz različitih klasa veoma se razlikuju, pa je pitanje klasifikacije veoma važno za dalje proučavanje ove teme!
Počnimo sa oksidi koji ne stvaraju so. Treba ih zapamtiti: NE, SiO, CO, N 2 O. Samo naučite ove četiri formule!
Da bismo napredovali dalje, moramo zapamtiti da u prirodi postoje dvije vrste jednostavnih supstanci - metali i nemetali (ponekad se razlikuje i grupa polumetala ili metaloida). Ako imate jasno razumijevanje o tome koji su elementi metali, nastavite čitati ovaj članak. Ako imate i najmanju sumnju, pogledajte materijal "Metali i nemetali" na toj web stranici.
Dakle, dozvolite mi da vam kažem da su svi amfoterni oksidi metalni oksidi, ali nisu svi metalni oksidi amfoterni. Navešću najvažnije od njih: BeO, ZnO, Al 2 O 3, Cr 2 O 3, SnO. Lista nije potpuna, ali svakako treba zapamtiti navedene formule! U većini amfoternih oksida, metal pokazuje oksidaciono stanje od +2 ili +3 (ali postoje izuzeci).
U sljedećem dijelu članka nastavit ćemo govoriti o klasifikaciji; Hajde da razgovaramo o kiselim i bazičnim oksidima.
Oksidi su složene supstance koje se sastoje od dva hemijska elementa, od kojih je jedan kiseonik sa oksidacionim stanjem ($-2$).
Opšta formula oksida je: $E_(m)O_n$, gdje je $m$ broj atoma elementa $E$, a $n$ broj atoma kisika. Oksidi mogu biti teško(pijesak $SiO_2$, sorte kvarca), tečnost(vodikov oksid $H_2O$), gasoviti(ugljični oksidi: ugljični dioksid $CO_2$ i ugljični dioksid $CO$ plinovi). By hemijska svojstva oksidi se dijele na soli koji stvaraju i ne stvaraju soli.
Ne stvara soli To su oksidi koji ne reagiraju s alkalijama ili kiselinama i ne stvaraju soli. Malo ih je, sadrže nemetale.
Formiranje soli To su oksidi koji reagiraju s kiselinama ili bazama i stvaraju sol i vodu.
Među oksidima koji stvaraju soli postoje oksidi bazična, kisela, amfoterna.
Osnovni oksidi- to su oksidi koji odgovaraju bazama. Na primjer: $CaO$ odgovara $Ca(OH)_2, Na_2O NaOH$.
Tipične reakcije bazičnih oksida:
1. Osnovni oksid + kiselina → sol + voda (reakcija razmjene):
$CaO+2HNO_3=Ca(NO_3)_2+H_2O$.
2. Bazni oksid + kiseli oksid → sol (reakcija spojeva):
$MgO+SiO_2(→)↖(t)MgSiO_3$.
3. Bazni oksid + voda → alkalija (složena reakcija):
$K_2O+H_2O=2KOH$.
Kiseli oksidi- to su oksidi koji odgovaraju kiselinama. To su oksidi nemetala:
N2O5 odgovara $HNO_3, SO_3 - H_2SO_4, CO_2 - H_2CO_3, P_2O_5 - H_3PO_4$, kao i metalni oksidi sa visokim stepenom oksidacije: $(Cr)↖(+6)O_3$ odgovara $H_2CrO_2)↖ +7 )O_7 — HMnO_4$.
Tipične reakcije kiselog oksida:
1. Kiseli oksid + baza → sol + voda (reakcija razmjene):
$SO_2+2NaOH=Na_2SO_3+H_2O$.
2. Kiseli oksid + bazični oksid → sol (složena reakcija):
$CaO+CO_2=CaCO_3$.
3. Kiseli oksid + voda → kiselina (složena reakcija):
$N_2O_5+H_2O=2HNO_3$.
Ova reakcija je moguća samo ako je kiseli oksid topiv u vodi.
Amfoterično nazivaju se oksidi, koji, ovisno o uvjetima, pokazuju bazična ili kisela svojstva. To su $ZnO, Al_2O_3, Cr_2O_3, V_2O_5$. Amfoterni oksidi se ne spajaju direktno s vodom.
Tipične reakcije amfoternih oksida:
1. Amfoterni oksid + kiselina → sol + voda (reakcija razmjene):
$ZnO+2HCl=ZnCl_2+H_2O$.
2. Amfoterni oksid + baza → sol + voda ili kompleksno jedinjenje:
$Al_2O_3+2NaOH+3H_2O(=2Na,)↙(\text"natrijum tetrahidroksoaluminat")$
$Al_2O_3+2NaOH=(2NaAlO_2)↙(\text"natrijum aluminat")+H_2O$.