pigments visuels. La zone rudimentaire de l'épiderme de la peau est constituée de couches. Vision diurne et nocturne
Les pigments visuels sont concentrés dans les membranes des segments externes. Chaque stick contient environ 10 8 molécules de pigment. Ils sont organisés en plusieurs centaines de disques discrets (environ 750 en baguette de singe) qui ne sont pas reliés à la membrane externe. Dans les cônes, le pigment est situé dans des plis pigmentaires spéciaux qui prolongent la membrane cellulaire externe du photorécepteur. Les molécules de pigment représentent environ 80 % de toutes les protéines du disque. Les pigments visuels sont si denses dans les membranes du segment externe que la distance entre deux molécules de pigment visuel dans le bâtonnet ne dépasse pas 10 nm. Un tel garnissage dense augmente la probabilité qu'un photon de lumière passant à travers une couche de cellules photoréceptrices soit capturé. La question suivante se pose : comment les signaux apparaissent-ils lorsque la lumière est absorbée par les pigments visuels ?
Absorption de la lumière par les pigments visuelsLes événements qui se produisent lorsque la lumière est absorbée par le pigment en forme de bâtonnet, la rhodopsine, ont été étudiés à l'aide de techniques psychophysiologiques, biochimiques et moléculaires. La molécule de pigment visuel est constituée de deux composants : une protéine, appelée opsine, et un chromophore, le 11-cis-vitamine A-aldéhyde, appelé rétinal (Fig. 1). Il convient de préciser que le chromophore contient un groupe chimique qui donne la couleur au composé. Les caractéristiques quantitatives de la capacité d'absorption des pigments ont été étudiées par spectrophotométrie. Lorsque la rhodopsine, le pigment visuel des bâtonnets, était illuminée par une lumière de différentes longueurs d'onde, la lumière bleu-vert d'une longueur d'onde d'environ 500 nm était mieux absorbée. Un résultat similaire a également été obtenu en éclairant une seule tige sous un microscope avec des faisceaux de lumière de différentes longueurs d'onde. A été révélé dépendance intéressante entre le spectre d'absorption de la rhodopsine et notre perception de la lumière crépusculaire. Des études psychophysiques quantitatives réalisées sur des humains ont montré que la lumière du jour bleu-vert avec une longueur d'onde d'environ 500 nm est optimale pour la perception de la lumière crépusculaire dans l'obscurité. Pendant la journée, lorsque les bâtonnets sont inactifs et que seuls des cônes sont utilisés, nous sommes plus sensibles à la couleur rouge correspondant au spectre d'absorption des cônes (nous en reparlerons plus tard).
Lorsqu'un photon est absorbé par la rhodopsine, la rétine subit une photoisomérisation et passe de la configuration 11-cis à la configuration trans. Cette transition se produit très rapidement : en environ 10-12 secondes. Après cela, la partie protéique du pigment subit également une série de changements transformationnels, avec la formation d'un certain nombre de produits intermédiaires. L'une des conformations de la fraction protéique, la métarhodopsine II, est la plus importante pour la transduction du signal (nous en discuterons plus tard dans ce chapitre). La figure 2 montre la séquence des événements lors de la décoloration et de la régénération de la rhodopsine active. La métarhodopsine II est formée après 1 ms. La régénération du pigment après sa désintégration se produit lentement, en quelques minutes ; cela nécessite le transport du rétinien des photorécepteurs vers l'épithélium pigmentaire.
La structure de la rhodopsineAu niveau moléculaire, la protéine opsine est constituée de 348 résidus d'acides aminés, formant 7 zones hydrophobes, chacune constituée de 20 à 25 acides aminés, constituant 7 hélices transmembranaires. L'extrémité N-terminale de la molécule est située dans l'espace extracellulaire (c'est-à-dire à l'intérieur du disque de la tige) et l'extrémité C-terminale est située dans le cytoplasme.
Dans l'obscurité, le 11-cis-rétinal est étroitement lié à la protéine opsine. La capture de photons conduit à l'isomérisation de tout le cis rétinien dans le trône rétinien. Dans ce cas, le complexe opsine all-tron-rétinien se transforme rapidement en métarhodopsine II, qui se dissocie en opsine et rétinien tout-tron. La régénération de la rhodopsine dépend de l'interaction des photorécepteurs et des cellules pigmentaires. La métarhodopsine II active et maintient le second système messager.
Le rétinal est relié à l'opsine par un résidu de lysine situé dans le septième segment transmembranaire. L'opsine appartient à une famille de protéines à 7 domaines transmembranaires, qui comprend également des récepteurs médiateurs métabotropiques, tels que les récepteurs adrénergiques et muscariniques. Comme la rhodopsine, ces récepteurs signalent aux seconds messagers via l'activation de la protéine G. La rhodopsine est remarquablement stable dans l'obscurité. Bayor a calculé que l'isomérisation thermique spontanée de la molécule de rhodopsine prend environ 3000 ans, soit 10 23 de plus que pour la photoisomérisation.
pigments visuels
pigments visuels
La structure de la rhodopsine
Cônes et vision des couleurs
daltonisme
Littérature
pigments visuels
Les pigments visuels sont concentrés dans les membranes des segments externes. Chaque stick contient environ 10 8 molécules de pigment. Ils sont organisés en plusieurs centaines de disques discrets (environ 750 en baguette de singe) qui ne sont pas reliés à la membrane externe. Dans les cônes, le pigment est situé dans des plis pigmentaires spéciaux qui prolongent la membrane cellulaire externe du photorécepteur. Les molécules de pigment représentent environ 80 % de toutes les protéines du disque. Les pigments visuels sont si denses dans les membranes du segment externe que la distance entre deux molécules de pigment visuel dans le bâtonnet ne dépasse pas 10 nm. Un tel garnissage dense augmente la probabilité qu'un photon de lumière passant à travers une couche de cellules photoréceptrices soit capturé. La question suivante se pose : comment les signaux apparaissent-ils lorsque la lumière est absorbée par les pigments visuels ?
Absorption de la lumière par les pigments visuels
Les événements qui se produisent lorsque la lumière est absorbée par le pigment en forme de bâtonnet, la rhodopsine, ont été étudiés à l'aide de techniques psychophysiologiques, biochimiques et moléculaires. La molécule de pigment visuel est constituée de deux composants : une protéine, appelée opsine, et un chromophore, le 11-cis-vitamine A-aldéhyde, appelé rétinal (Fig. 1). Il convient de préciser que le chromophore contient un groupe chimique qui donne la couleur au composé. Les caractéristiques quantitatives de la capacité d'absorption des pigments ont été étudiées par spectrophotométrie. Lorsque la rhodopsine, le pigment visuel des bâtonnets, était illuminée par une lumière de différentes longueurs d'onde, la lumière bleu-vert d'une longueur d'onde d'environ 500 nm était mieux absorbée. Un résultat similaire a également été obtenu en éclairant une seule tige sous un microscope avec des faisceaux de lumière de différentes longueurs d'onde. Une relation intéressante a été trouvée entre le spectre d'absorption de la rhodopsine et notre perception de la lumière crépusculaire. Des études psychophysiques quantitatives réalisées sur des humains ont montré que la lumière du jour bleu-vert avec une longueur d'onde d'environ 500 nm est optimale pour la perception de la lumière crépusculaire dans l'obscurité. Pendant la journée, lorsque les bâtonnets sont inactifs et que seuls des cônes sont utilisés, nous sommes plus sensibles à la couleur rouge correspondant au spectre d'absorption des cônes (nous en reparlerons plus tard).
Lorsqu'un photon est absorbé par la rhodopsine, la rétine subit une photoisomérisation et passe de la configuration 11-cis à la configuration trans. Cette transition se produit très rapidement : en environ 10-12 secondes. Après cela, la partie protéique du pigment subit également une série de changements transformationnels, avec la formation d'un certain nombre de produits intermédiaires. L'une des conformations de la fraction protéique, la métarhodopsine II, est la plus importante pour la transduction du signal (nous en discuterons plus loin dans ce chapitre). La figure 2 montre la séquence des événements lors de la décoloration et de la régénération de la rhodopsine active. La métarhodopsine II est formée après 1 ms. La régénération du pigment après sa désintégration se produit lentement, en quelques minutes ; cela nécessite le transport du rétinien des photorécepteurs vers l'épithélium pigmentaire.
La structure de la rhodopsine
Au niveau moléculaire, la protéine opsine est constituée de 348 résidus d'acides aminés, formant 7 zones hydrophobes, chacune constituée de 20 à 25 acides aminés, constituant 7 hélices transmembranaires. L'extrémité N-terminale de la molécule est située dans l'espace extracellulaire (c'est-à-dire à l'intérieur du disque de la tige) et l'extrémité C-terminale est située dans le cytoplasme.
Fig. 1. Structure de la rhodopsine des vertébrés intégrée dans la membrane du photorécepteur. La spirale est quelque peu déroulée pour montrer l'emplacement du rétinien (indiqué en noir). C - C-terminal, N - N-terminal.
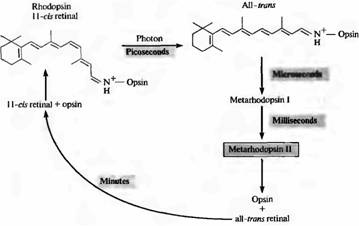
Fig.2. L'efflorescence de la rhodopsine à la lumière. Dans l'obscurité, le 11-cis-rétinal est étroitement lié à la protéine opsine. La capture de photons conduit à l'isomérisation de tout le cis rétinien dans le trône rétinien. Dans ce cas, le complexe opsine all-tron-rétinien se transforme rapidement en métarhodopsine II, qui se dissocie en opsine et rétinien tout-tron. La régénération de la rhodopsine dépend de l'interaction des photorécepteurs et des cellules pigmentaires. La métarhodopsine II active et maintient le second système messager.
Le rétinal est relié à l'opsine par un résidu de lysine situé dans le septième segment transmembranaire. L'opsine appartient à une famille de protéines à 7 domaines transmembranaires, qui comprend également des récepteurs médiateurs métabotropiques, tels que les récepteurs adrénergiques et muscariniques. Comme la rhodopsine, ces récepteurs signalent aux seconds messagers via l'activation de la protéine G. La rhodopsine est remarquablement stable dans l'obscurité. Bayor a calculé que l'isomérisation thermique spontanée de la molécule de rhodopsine prend environ 3000 ans, soit 10 23 de plus que pour la photoisomérisation.
Cônes et vision des couleurs
Les recherches et les expériences étonnantes menées par Young et Helmholtz au 19e siècle ont attiré l'attention sur la très problème important sur la vision des couleurs, et les scientifiques eux-mêmes ont donné une explication claire et précise de ce phénomène. Leur conclusion sur l'existence de trois divers types photorécepteurs de couleur a résisté à l'épreuve du temps et a ensuite été validé au niveau moléculaire. Encore une fois, nous pouvons citer Helmholtz, qui a comparé la perception de la lumière et du son, la couleur et la tonalité sonore. On peut envier la clarté, la puissance et la beauté de sa pensée, surtout si on la compare aux concepts vitalistes confus qui se sont répandus au XIXe siècle :
Toutes les différences de tons de couleur dépendent de la combinaison dans diverses proportions des trois couleurs primaires ... rouge, vert et violet ... Tout comme la perception de la lumière du soleil et sa chaleur dépendent ... si les rayons du soleil frappent le nerfs, provenant des récepteurs de la vision ou des récepteurs de la sensibilité thermique. Comme Young l'a suggéré dans son hypothèse, la différence de perception des différentes couleurs dépend simplement de celui des 3 types de photorécepteurs qui est le plus activé par cette lumière. Lorsque les trois types sont également excité, il devient blanc...
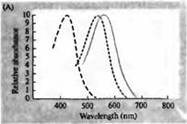
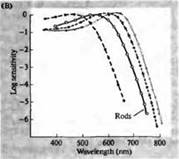
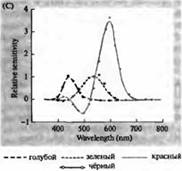
Riz. 3. Spectres de sensibilité des photorécepteurs humains et divers pigments visuels. (A) Courbes de sensibilité de trois pigments visuels de couleur montrant des pics d'absorption à des longueurs d'onde correspondant au cyan, au vert et au rouge. (B) Spectres de sensibilité des cônes au bleu, au vert et au rouge et aux bâtonnets (en noir) chez les macaques. Les réponses ont été enregistrées à l'aide d'électrodes d'aspiration, moyennées et normalisées. Les courbes du spectre des bâtonnets ont été obtenues dans l'étude des pigments visuels chez l'homme. (C) Comparaison des spectres de singe et de cône humain à l'aide d'un test de sensibilité aux couleurs. La courbe continue montre une expérience pour déterminer la sensibilité à la couleur chez l'homme, lorsqu'il est présenté avec de la lumière de différentes longueurs d'onde. La ligne pointillée montre les résultats prédits sur la base de l'enregistrement des courants dans les cônes individuels, après correction de l'absorption de la lumière dans la lentille et des pigments sur le chemin vers le segment externe. L'accord entre les résultats des deux expériences est étonnamment élevé.
Si on projette deux faisceaux lumineux de couleurs différentes en même temps sur un écran blanc... on ne voit qu'une seule couleur, plus ou moins différente de ces deux couleurs. On comprend mieux le fait remarquable que l'on est capable de percevoir toutes les nuances de la composition de la lumière extérieure par un mélange de trois couleurs primaires, si l'on compare l'œil à un sec... Dans le cas du son... on entendre des ondes plus longues comme des sons graves et des ondes courtes - aussi hautes et perçantes, de plus, l'oreille est capable de capter plusieurs ondes sonores en même temps, c'est-à-dire nombreuses notes. Cependant, ils β dans ce cas ne fusionnent pas en un accord complexe, tout comme différentes couleurs ... fusionnent en une seule couleur complexe. L'œil ne peut pas faire la différence si nous remplaçons couleur orange au rouge ou au jaune; mais si nous entendons les notes do et mi sonner en même temps, un tel son ne nous apparaît pas comme une note re. Si l'oreille percevait les sons musicaux comme l'œil perçoit les couleurs, chaque accord pourrait être représenté par une combinaison de trois notes constantes, une très grave, une très aiguë et une intermédiaire, ne produisant tous les effets musicaux possibles qu'en changeant le volume relatif de ces notes. trois notes... Cependant, nous sommes capables de voir la transition en douceur des couleurs de l'une à l'autre à travers un nombre infini de nuances et de dégradés... La façon dont nous percevons chacune des couleurs... dépend principalement de la structure de notre système nerveux. Il faut admettre qu'à l'heure actuelle, ni chez l'homme ni chez les tétrapodes, une base anatomique n'a été décrite pour confirmer la théorie de la perception des couleurs.
Ces prédictions précises et clairvoyantes ont été confirmées par une série d'observations différentes. En utilisant la spectrophotométrie, Wald, Brouck, McNicol et Dartnell et al ont montré la présence de trois types de cônes avec différents pigments dans la rétine humaine. Baylor et ses collègues ont également réussi à détourner les courants des cônes des singes et des humains. Il a été constaté que les trois populations de cônes avaient des plages de sensibilité différentes mais qui se chevauchaient pour les parties bleue, verte et rouge du spectre. Les longueurs d'onde optimales pour l'excitation des signaux électriques coïncidaient exactement avec les pics d'absorption de la lumière par les pigments visuels, établis à l'aide de la spectrophotométrie et d'expériences psychophysiques pour mesurer la sensibilité de l'œil au spectre des couleurs. Finalement, Natais a cloné et séquencé les gènes codant pour le pigment d'opsine dans trois types de cônes sensibles au rouge, au vert et au bleu.
Comment, alors, les molécules de divers pigments visuels sont-elles capables de capter préférentiellement la lumière d'une certaine longueur d'onde ? Il s'avère que la rhodopsine est le pigment visuel des bâtonnets et que les trois pigments visuels des cônes contiennent le même chromophore, le 11-cis-rétinal. Cependant, les séquences d'acides aminés de la partie protéique du pigment diffèrent les unes des autres. Des différences dans quelques acides aminés seulement expliquent leur sensibilité différente au spectre.
daltonisme
Bien qu'un type de photorécepteur soit incapable de percevoir la couleur par lui-même, les trois types de cônes, comme le montre la Fig. 4, déjà capable.
En principe, deux types de cônes avec des pigments différents suffiraient pour la reconnaissance des couleurs, mais dans ce cas, plusieurs combinaisons de longueurs d'onde seraient perçues de la même manière. Une situation similaire se produit lorsqu'une personne souffre de daltonisme. Ces personnes, comme l'a montré Nathans, ont des défauts génétiques qui conduisent à l'absence de l'un des pigments. Du point de vue de l'état actuel de la science, nous ne pouvons qu'être étonnés de la beauté des mécanismes moléculaires confirmant la pensée brillante et étonnamment précise de Young et Helmholtz.
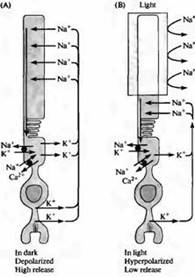
Riz. 4. Courant "noir" dans un bâton. (A) Dans l'obscurité, les ions sodium traversent les canaux cationiques dans le segment externe des bâtonnets, provoquant une dépolarisation ; les ions calcium sont également capables de traverser ces canaux cationiques. La boucle de courant traverse l'isthme de la tige en raison du fait que le courant de potassium circule vers l'extérieur dans le segment interne de la membrane. (B) Lorsque le segment externe est illuminé, les canaux se ferment en raison d'une diminution de la concentration intracellulaire de cGMP et la tige s'hyperpolarise. L'hyperpolarisation entraîne une diminution de la libération du neurotransmetteur. Les concentrations de sodium, potassium et calcium sont maintenues à l'intérieur du stick par des pompes spéciales et des échangeurs d'ions situés dans la zone du segment intérieur (cercles noirs). Des transporteurs de calcium se trouvent également dans le segment externe.
Leur idée que les principaux attributs de la vision des couleurs et du daltonisme devraient être trouvés dans les photorécepteurs eux-mêmes a été confirmée par des mesures physiologiques directes, ainsi que par l'étude des différences dans la structure des pigments aux niveaux génétique et protéique, le potentiel est de l'ordre de -40 mV, ce qui est loin du potentiel potassique d'équilibre E K, qui est de - 80 mV.

Riz. 5. Le rôle du cGMP dans l'ouverture des canaux sodiques dans le segment externe des bâtonnets. L'activité des canaux uniques a été enregistrée à l'aide d'un patch clamp à l'envers, qui étaient en solution avec différentes concentrations de cGMP. L'ouverture du canal fait dévier le courant vers le haut. La fréquence d'ouverture du canal était très faible dans le contrôle, l'ajout de cGMP a entraîné une augmentation de la fréquence d'ouverture du canal unique, qui dépendait directement de la concentration de cGMP.
Le courant entrant dans l'obscurité est transporté principalement par des ions sodium suivant un gradient électrochimique à travers les canaux cationiques du segment externe. L'hyperpolarisation du photorécepteur sous l'action de la lumière est due à la fermeture de ces canaux, ce qui entraîne un déplacement du potentiel de membrane vers E K.
Propriétés des canaux photorécepteurs
Les canaux cationiques du segment externe dans des conditions physiologiques ont un rapport dans la conductivité des ions calcium/sodium/potassium de 12,5 : 1,0 : 0,7 et la conductivité d'un seul canal est d'environ 0,1 pS 21). Parce que la concentration de sodium est beaucoup plus élevée que la concentration de calcium, environ 85% du courant entrant est constitué d'ions sodium. La force motrice des ions potassium est dirigée vers l'extérieur de la cellule. Lorsque les ions calcium traversent le canal, ces ions sont fermement liés à la paroi des pores et interfèrent ainsi avec la conduction d'autres ions. C'est pour cette raison que l'élimination du calcium du milieu extracellulaire conduit à un passage plus facile des ions potassium et sodium à travers les canaux dont la conductivité augmente jusqu'à 25 pS.
Fesenko, Yau, Baylor, Strayer et leurs collègues ont montré que le HMP cyclique joue le rôle de porteur de signal interne du disque à la surface de la membrane. Comme le montre la figure 4, une concentration élevée de cGMP dans le cytoplasme maintient les canaux cationiques ouverts. Avec une diminution de la concentration de cGMP de la surface interne de la membrane, l'ouverture des canaux cationiques devient un événement rare. Ainsi, le potentiel membranaire des photorécepteurs est le reflet de la concentration de cGMP dans le cytoplasme : plus la concentration de cGMP est élevée, plus la dépolarisation de la cellule est importante. La concentration de cGMP, à son tour, dépend de l'intensité de la lumière incidente. Une augmentation de l'intensité lumineuse entraîne une diminution de la concentration de cGMP et réduit la proportion de canaux ouverts. En l'absence de cGMP, presque tous les canaux sont fermés et la résistance de la membrane du segment externe se rapproche de la résistance de la bicouche lipidique.
Structure moléculaire des canaux cGMP-dépendants
L'ADNc a été isolé pour les canaux ioniques du segment externe des bâtonnets et les séquences d'acides aminés des sous-unités de ces canaux dans les rétines humaines, bovines, de souris et de poulet ont été déterminées. Une similitude significative de l'ADN a été trouvée pour ces canaux ioniques et d'autres canaux ioniques cGMP - tels que ceux trouvés dans l'olfactif
Transduction du signal dans les photorécepteurs
Comment la photoisomérisation de la rhodopsine entraîne-t-elle une modification du potentiel de membrane ? Il a été compris au fil des années qu'une sorte d'intermédiaire interne était nécessaire pour exciter les signaux électriques dans les tiges et les cônes. L'une des raisons de soupçonner que les informations sur l'absorption des photons dans la région du segment externe de la tige sont transmises par un porteur était le fait que le pigment rhodopsine lui-même est situé à l'intérieur du disque et que le signal se propage à travers le cytoplasme vers l'extérieur. membrane. La deuxième raison était une augmentation significative de la réponse. Baylor et ses collègues, étudiant les photorécepteurs chez les tortues, ont montré qu'une diminution de la conductivité membranaire et des signaux électriques enregistrés se produit déjà lorsqu'un seul photon est absorbé et qu'une des 10 8 molécules de pigment est activée.
La séquence d'événements dans lesquels une molécule de photopigment activé modifie le potentiel de membrane a été élucidée en étudiant les segments externes des bâtonnets et des cônes à l'aide de méthodes de serrage de potentiel à deux électrodes et de biologie moléculaire. Le schéma de transmission du signal de l'absorption d'un photon de lumière à un signal électrique est illustré à la fig. 3.
Dans l'obscurité, un courant « noir » entrant constant circule dans les segments extérieurs des bâtonnets et des cônes. Le résultat est leur système membranaire. Les régions membranaires de ces canaux présentent des similitudes structurelles avec d'autres canaux sélectifs pour les cations, en particulier dans la région S4 et dans la région qui forme le pore ionique. Les canaux ioniques photorécepteurs sont des tétramères composés d'au moins 2 sous-unités protéiques différentes avec un poids moléculaire de 63 et 240 kDa, respectivement.
Les sites de liaison intracellulaire des nucléotides sont situés près de l'extrémité carboxyle des sous-unités. L'expression de ces sous-unités dans les ovocytes conduit à la formation de canaux cationiques aux propriétés similaires à celles situées dans les segments externes des bâtonnets : ils sont activés par le cGMP et présentent les rapports attendus de conductivité et de perméabilité.

Riz. 6. Le mécanisme d'activation de la protéine G lors de l'activation de la molécule de photopigment. La transducine de la protéine G se lie au GTP en présence de métarhodopsine II, ce qui conduit à l'activation de la phosphodiestérase, qui, à son tour, hydrolyse le cGMP. Lorsque la concentration de cGMP diminue, les canaux sodiques se ferment.
Cascade métabolique du GMP cyclique
La chaîne d'événements conduisant à une diminution de la concentration de cGMP et à la fermeture ultérieure des canaux ioniques est illustrée à la Fig. 5. Une diminution de la concentration intracellulaire de cGMP est provoquée par la lumière, conduisant à la formation de métarhodopsine II, un produit intermédiaire dans la dégradation du photopigment. La métarhodopsine II agit à son tour sur la transducine de la protéine G, constituée de 3 chaînes polypeptidiques
L'interaction de la métarhodopsine II et de la transducine conduit au remplacement de la molécule de GDP liée à la protéine G par du GTP. Cela active la sous-unité de la protéine G, qui se détache des sous-unités et, à son tour, active la phosphodiestérase située dans la région membranaire : une enzyme qui hydrolyse le cGMP. La concentration de cGMP diminue, il y a moins de canaux ioniques ouverts, le bâtonnet devient hyperpolarisé. La cascade est interrompue par la phosphorylation de l'extrémité C-terminale de la métarhodopsine II active. Le rôle clé du cGMP dans la régulation de l'état des canaux cationiques a été confirmé par des expériences biochimiques. L'illumination des photorécepteurs peut entraîner une baisse de 20 % du niveau de cGMP dans la cellule.
Récepteurs de vertébrés qui se dépolarisent lors de l'exposition à la lumière
Une exception intéressante au mécanisme de photoréception indiqué ci-dessus sont certains récepteurs de vertébrés. Les lézards ont un troisième œil situé sur le dessus de leur tête. Il contient de petits "cônes" capables de percevoir une image similaire à celle perçue par les yeux principaux (latéraux). Ces photorécepteurs, cependant, sont remarquables en ce qu'ils se dépolarisent lors de l'illumination. Les canaux activés par les nucléotides ont ici une structure et une fonction similaires aux photorécepteurs d'autres vertébrés, à une exception près : l'activation du photorécepteur et de la protéine G entraîne une augmentation de la concentration de cGMP. En conséquence, les canaux du segment externe s'ouvrent et les cations sont dirigés dans la cellule, formant un courant "léger". Cela est dû à l'inhibition de l'activité de la phosphodiestérase dans l'obscurité. En conséquence, la séquence d'événements suivante se produit dans l'œil du lézard : lumière - [cGMP] - ouverture des canaux cationiques du segment externe - dépolarisation.
Amplification du signal dans la cascade cGMP
La cascade cGMP à deux étages fournit une amplification significative du signal d'origine, ce qui explique la sensibilité exceptionnelle des bâtonnets à la lumière. Premièrement, une molécule de métarhodopsine II active catalyse l'ajout de nombreuses molécules de GTP au lieu de GDP et libère ainsi des centaines de sous-unités de protéine G. Deuxièmement, chaque sous-unité active une molécule de phosphodiestérase dans le disque, qui est capable de cliver un grand nombre de molécules de cGMP situées dans le cytoplasme, et ainsi conduire à la fermeture d'un grand nombre de canaux.
Signaux en réponse à des quanta de lumière uniques
Les données selon lesquelles un seul quanta de lumière peut provoquer la sensation perçue de lumière causée un grand nombre de des questions. Quelle est la taille de cette réponse unique ? Comment ce signal se démarque-t-il du bruit de fond ? Et comment ces informations sont-elles transmises de manière fiable de la rétine aux centres visuels supérieurs ? Pour mesurer les signaux en réponse à des quanta de lumière uniques, Baylor et ses collègues ont enregistré des courants provenant de bâtonnets individuels dans les rétines de crapauds, de singes et d'humains. Ces expériences sont un exemple unique d'une expérience qui montre comment une telle processus difficile, comme la perception de faibles éclairs de lumière, peut être corrélée avec des changements se produisant au niveau des molécules individuelles.
La procédure d'isolement d'un fragment de rétine à partir de matériel animal ou cadavérique doit être effectuée dans l'obscurité pour ces expériences. Pour mesurer le courant, le segment externe du stick est aspiré dans une fine pipette. Comme prévu, ces expériences montrent que dans l'obscurité, un courant circule constamment à l'intérieur du segment externe. Des éclairs de lumière ferment les canaux du segment externe, provoquant une diminution du courant "d'obscurité". L'amplitude du courant est faible et proportionnelle au nombre de photons absorbés. Parfois, le flash provoque une réponse unique, parfois une double réponse, et parfois aucune réponse du tout.
Chez les bâtonnets de singe, la diminution du courant en réponse à l'absorption d'un photon est d'environ 0,5 pA. Cela correspond à la fermeture d'environ 300 canaux, c'est-à-dire de 3 à 5% de tous les canaux ouverts dans l'obscurité. Ceci est réalisé grâce à une augmentation significative du signal dans le métabolisme Cascade cGMP. De plus, en raison de l'extrême stabilité des pigments visuels mentionnés précédemment, l'isomérisation aléatoire et la fausse fermeture du canal sont des événements très rares. Cela fait ressortir les effets des quanta de lumière individuels sur un fond de bruit CC très faible. Il a été démontré que le couplage électrique de la jonction lacunaire entre les photorécepteurs fournit un effet de lissage supplémentaire qui réduit le bruit de fond et améliore le rapport signal sur bruit des réponses de la tige aux quanta uniques.
Littérature
1. Finn, J.T., Grunwald, M.E et Yau, K-W. 1996. Canaux ioniques nucléotidiques cycliques : une famille élargie aux fonctions diverses. Annu. Tour. Physiol.58 : 395-426.
2. Nakanishi, S., Nakajima, Y., Masu, M., Ueda, Y, Nakahara, K., Watanabe, D., Yamaguchi, S., Kawabata, S. et Okada, M. 1998. Récepteurs du glutamate : Fonction cérébrale et transduction du signal.
PIGMENTS VISUELS(lat. pigmentum paint) - pigments photosensibles des photorécepteurs de la rétine. Percevant l'énergie d'une impulsion lumineuse, 3. les objets subissent un cycle photochimique complexe. transformations, à la suite desquelles un récepteur visuel séparé de la rétine, contenant 3. p (un cône ou une tige), passe dans un état excité et transmet les informations reçues le long du nerf optique à c. n.m. Avec. Étant la principale partie structurelle et fonctionnelle de la membrane photoréceptrice des cellules visuelles de la rétine, 3. p. rôle clé dans les mécanismes de la vision (voir).
Nomenclature et structure des pigments visuels. Tous les 3. p étudiés de vertébrés et d'invertébrés sont des complexes de l'opsine, une protéine membranaire insoluble dans l'eau, et du chromophore (rétinien) qui lui est associé. Le rétinal, ou aldéhyde de vitamine A, peut exister sous deux formes, rétinal1 et rétinal2.
De par la nature d'un chromophore 3. l'élément est divisé en deux classes - les rhodopsines (voir), contenant du rétinal1, et les porphyropsines contenant du rétinal2. Les rhodopsines se trouvent dans la rétine de l'œil de tous les animaux terrestres et marins, les porphyropsines se trouvent dans la rétine des yeux des animaux d'eau douce. Certains poissons et amphibiens ont en même temps 3 p contenant de la rétine ! et rétinienne. Il existe des tentatives de classification de 3.p sur la base des différences d'opsines spécifiques aux bâtonnets ou aux cônes de la rétine. Par exemple, la rhodopsine est un complexe de rétinal1 avec de l'opsine en bâtonnet, l'iodopsine est un complexe de rétinal1 avec de l'opsine en cône, la porphyropsine est du rétinal2 avec de l'opsine en bâtonnet, le complexe rétinal-cône d'opsine forme de la cyanopsine. Cependant, il est extrêmement difficile de classer 3. les éléments sur la base des opsins, car il existe au moins cinq opsins différents.
De tous les éléments connus, les rhodopsines isolées des yeux d'un taureau, d'une grenouille et d'un calmar ont été les plus étudiées. Leur plaidoyer. poids (masse) de l'ordre de 30 à 40 000, chaque molécule contient env. 400 acides aminés et un chromophore. De plus, la chaîne oligosaccharidique est incluse dans la molécule de 3. p. : 3 radicaux glucosamine, 2 mannose, 1 galactose. Les lipides (ch. arr. phospholipides) forment un complexe fort avec la molécule 3. p. Tout en conservant leurs propriétés spectrales de base (voir Analyse spectrale), 3. les éléments sans lipides perdent un certain nombre de propriétés importantes sur le plan fonctionnel, par exemple la capacité de récupération.
La rétine pure a jaune, le maximum de son spectre d'absorption se situe aux alentours de 370 nm. L'opsine est incolore, le maximum d'absorption se situe dans la région ultraviolette (environ 280 nm). La couleur de la molécule de rhodopsine est rose rougeâtre, le spectre d'absorption maximal est d'env. 500 nm. La raison d'un tel décalage spectral lors de la formation du complexe (de 370 à 500 nm - le soi-disant décalage bathochromique) n'a pas encore reçu d'explication sans ambiguïté.
Les maxima des spectres d'absorption des rhodopsines et des porphyropsines capturent une région assez large du spectre visible - de 433 à 562 nm pour les rhodopsines et de 510 à 543 nm pour les porphyropsines. Si les porphyropsines incluent également les cônes 3.p. du têtard d'une grenouille, d'une carpe et d'une tortue d'eau douce, c'est-à-dire la cyanopsine avec un spectre d'absorption maximal à 620 nm, alors cette région est encore plus large. Le développement de méthodes de microspectrophotométrie a permis de déterminer les spectres d'absorption de nombreux types de cellules photoréceptrices uniques chez les animaux et les humains. Selon les données obtenues, 3 p de la rétine humaine ont les maxima de spectre d'absorption suivants : bâtonnets 498, cônes sensibles au bleu, au vert et au rouge - 440, 535 et 575 nm, respectivement.
L'étude de 3. P. a commencé en allemand. le chercheur H. Muller, qui en 1851 a décrit comment la rétine rose-violet extraite de l'œil d'une grenouille devient d'abord jaunâtre à la lumière, puis blanchâtre. En 1877, F. Boll a également décrit ce phénomène, concluant qu'une sorte de substance sensible à la lumière rouge est située dans les cellules visuelles de la rétine et que la décoloration de cette substance est associée au mécanisme de la vision. Un grand mérite dans l'étude de 3. P. appartient à Kuhne (W. Kuhne, 1877), Krom a réussi à isoler 3. P. et à les étudier en détail. Il a appelé le 3.p extrait par lui violet visuel, a établi sa nature protéique, a étudié certaines de ses propriétés spectrales et phototransformations, a découvert la capacité de 3.p à se rétablir dans l'obscurité. Amer. a apporté une grande contribution à l'étude de 3. p. biochimiste et physiologiste J. Wald.
Phototransformations des pigments visuels. Sous l'influence de la lumière sur 3. p., un cycle photochimique se produit en eux. transformations, qui sont basées sur la réaction photochimique primaire d'isomérisation cis-trans du rétinal (voir Isomérie). Dans ce cas, la liaison entre le chromophore et la protéine est rompue. La séquence des transformations de 3.p peut être représentée comme suit : rhodopsine (le chromophore est sous forme cis) -> prélumirhodopsine -> lumirhodopsine -> métarhodopsine I -> métarhodopsine II -> protéine opsine -> chromophore sous forme trans. Sous l'influence de l'enzyme - la rétinol déshydrogénase - cette dernière passe dans la vitamine A, qui provient des segments externes des bâtonnets et des cônes dans les cellules de la couche pigmentaire de la rétine. Lorsque l'œil est assombri, la régénération se produit 3. p., pour la mise en œuvre d'une coupe, la présence d'un isomère cis de la vitamine A, qui sert de produit de départ pour la formation d'un chromophore (vitamine A aldéhyde), est nécessaire. Avec un manque ou une absence de vitamine A dans le corps, la formation de rhodopsine peut être perturbée et se développer à la suite d'un trouble de la vision crépusculaire, le soi-disant. cécité nocturne (voir Héméralopie). Dans le processus de phototransformation de la rhodopsine au stade de la transition de la lumirhodopsine à la métarhodopsine I dans la cellule réceptrice se produit en réponse à un flash lumineux de la soi-disant. potentiel de récepteur précoce (courte latence). Cependant, il n'est pas signal visuel, bien qu'il puisse servir de l'un des tests pour étudier le mécanisme des transformations de 3. p. dans la membrane photoréceptrice. La valeur fonctionnelle est la soi-disant. potentiel récepteur tardif, la période de latence to-rogo (5-10 msec) est proportionnelle au temps de formation de la métarhodopsine II. On suppose que la réaction de transition de la métarhodopsine I à la métarhodopsine II donne l'apparition d'un signal visuel.
Étant donné que 3. les objets sont continuellement décolorés à la lumière, il doit y avoir des mécanismes pour leur restauration constante. Certains d'entre eux sont extrêmement rapides (photorégénération), d'autres sont assez rapides (biochimique, régénération, Dark), d'autres sont lents (synthèse de 3. p. Lors du renouvellement constant de la membrane photoréceptrice dans la cellule visuelle). La photorégénération a fiziol, la valeur chez les animaux invertébrés (par exemple, chez céphalopodes- calmar, poulpe). Dans le mécanisme de la biochimie. régénération 3. p.chez les vertébrés, un rôle important est apparemment joué par l'enzyme isomérase (voir), qui assure l'isomérisation du trans-rétinal (ou trans-vitamine A) à nouveau sous la forme cis-isomère. Cependant, il n'existe aucune preuve définitive de l'existence d'une telle enzyme. La même réaction de formation d'une molécule de 3.p en présence de l'isomère 11-cis du rétinal et de l'opsine dans le système se produit facilement, sans dépense d'énergie. La capacité de la rhodopsine blanchie à la réaction de phosphorylation est trouvée (voir); on suppose que cette réaction est l'un des maillons du mécanisme d'adaptation à la lumière de la cellule visuelle.
Bibliographie: Ackerman Yu. Biophysique, trad. de l'anglais, M., 1964 ; Willie K. et Det e V. Biology, trad. de l'anglais, M., 1974, bibliographie; Konev S. V. et Volotovsky I. D. Introduction à la photobiologie moléculaire, p. 61, Minsk, 1971; Ostrovsky M. A. et Fedorovich I. B. Modifications photoinduites de la membrane photoréceptrice, dans le livre : Structure et fonctions du biol, membranes, éd. A. S. Troshina et autres, p. 224, M., 1975, bibliogr.; Physiologie des systèmes sensoriels, éd. G.V. Gershuni, partie 1, p. 88, L., 1971; Biochimie et physiologie des pigments visuels, éd. par H. Langer, B. a. o., 1973 ; Manuel de physiologie sensorielle, éd. par H.A.R. Jung a. o., v. 7, parties 1-2, B., 1972.
M. A. Ostrovsky.



