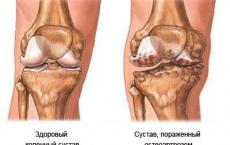
مثال على تفاعل الملح والملح. الخواص الكيميائية للأملاح وطرق تحضيرها
أسس
القواعد هي مركبات تحتوي فقط على هيدروكسيد أيونات OH على شكل أنيونات. يحدد عدد أيونات الهيدروكسيد التي يمكن استبدالها ببقايا الحمض حموضة القاعدة. في هذا الصدد، تكون القواعد عبارة عن حمض واحد وحمضين ومتعدد الأحماض، ومع ذلك، غالبًا ما يشار إلى القواعد ذات الحمض الواحد والحمضين على أنها قواعد حقيقية. من بينها يجب التمييز بين القواعد القابلة للذوبان في الماء وغير القابلة للذوبان في الماء. لاحظ أن القواعد القابلة للذوبان في الماء والقواعد المنفصلة تمامًا تقريبًا تسمى القلويات (الشوارد القوية). وتشمل هذه هيدروكسيدات العناصر القلوية والقلوية الأرضية وليس بأي حال من الأحوال محلول الأمونيا في الماء.
يبدأ اسم القاعدة بكلمة هيدروكسيد، وبعد ذلك يتم إعطاءها في الحالة المضاف إليها الاسم الروسيالكاتيون، ويشار إلى شحنته بين قوسين. يُسمح بإدراج عدد أيونات الهيدروكسيد باستخدام البادئات di-، tri-، tetra. على سبيل المثال: Mn (OH) 3 - هيدروكسيد المنغنيز (III) أو ثلاثي هيدروكسيد المنغنيز.
يرجى ملاحظة أن هناك علاقة وراثية بين القواعد والأكاسيد الأساسية: القواعد تتوافق مع الأكاسيد الأساسية. لذلك، غالبًا ما تحتوي الكاتيونات الأساسية على شحنة واحدة أو اثنتين، وهو ما يتوافق مع أقل حالات الأكسدة للمعادن.
تذكر الطرق الأساسية للحصول على الأسباب
1. تفاعل المعادن النشطة مع الماء :
2Na + 2H 2 O \u003d 2NaOH + H 2
La + 6H 2 O \u003d 2La (OH) 3 + 3H 2
تفاعل الأكاسيد الأساسية مع الماء:
CaO + H 2 O \u003d Ca (OH) 2
أهداب الشوق + ح 2 يا \u003d ملغ (أوه) 2.
3. تفاعل الأملاح مع القلويات :
MnSO 4 + 2KOH \u003d Mn (OH) 2 ↓ + K 2 SO 4
NH 4 C1 + NaOH \u003d NaCl + NH 3 ∙ H 2 O
Na 2 CO 3 + Ca (OH) 2 \u003d 2NaOH + CaCO 3
MgOHCl + NaOH \u003d Mg (OH) 2 + NaCl.
التحليل الكهربائي للمحاليل المائية للأملاح مع الحجاب الحاجز:
2NaCl + 2H2O → 2NaOH + Cl2 + H2
يرجى ملاحظة أنه في الفقرة 3، يجب اختيار كواشف البداية بحيث يكون من بين منتجات التفاعل إما مركب قليل الذوبان أو إلكتروليت ضعيف.
لاحظ أنه عند النظر في الخواص الكيميائية للقواعد، تعتمد ظروف التفاعل على قابلية ذوبان القاعدة.
1. التفاعل مع الأحماض :
NaOH + H 2 SO 4 \u003d NaH SO 4 + H 2 O
2NaOH + H 2 SO 4 \u003d Na 2 SO 4 + 2H 2 O
2Mg(OH) 2 + H 2 SO 4 = (MgOH) 2 SO 4 + 2H 2 O
Mg(OH) 2 + H 2 SO 4 = MgSO 4 + 2H 2 O
ملغ (OH) 2 + 2H 2 SO 4 \u003d ملغ (H SO 4) 2 + 2 H 2 O
2. التفاعل مع أكاسيد الأحماض :
هيدروكسيد الصوديوم + CO 2 \u003d NaHCO 3
2NaOH + CO 2 \u003d Na 2 CO 3 + H 2 O
الحديد (OH) 2 + P 2 O 5 \u003d الحديد (PO 3) 2 + H 2 O
ZFe (OH) 2 + P 2 O 5 \u003d Fe 3 (PO 4) 2 + 2H 2 O
3. التفاعل مع الأكاسيد المذبذبة:
A1 2 O 3 + 2NaOH ص + 3H 2 O \u003d 2Na
Al 2 O 3 + 2NaOH T \u003d 2NaAlO 2 + H 2 O
Cr 2 O 3 + Mg (OH) 2 \u003d Mg (CrO 2) 2 + H 2 O
4. التفاعل مع هيدروكسيدات الأمفتريك:
Ca (OH) 2 + 2Al (OH) 3 \u003d Ca (AlO 2) 2 + 4H 2 O
3NaOH + الكروم (OH) 3 = نا 3
التفاعل مع الأملاح.
إلى التفاعلات الموصوفة في الفقرة 3 من طرق التحضير، ينبغي إضافة:
2ZnSO 4 + 2KOH = (ZnOH) 2 S0 4 + K 2 SO 4
NaHCO 3 + NaOH \u003d Na 2 CO 3 + H 2 O
BeSO 4 + 4NaOH \u003d Na 2 + Na 2 SO 4
Cu(OH) 2 + 4NH 3 ∙H 2 O \u003d (OH) 2 + 4H 2 O
6. الأكسدة إلى هيدروكسيدات أو أملاح مذبذبة:
4Fe(OH) 2 + O2 + 2H2O = 4Fe(OH) 3
2Cr(OH) 2 + 2H2O + Na2O2 + 4NaOH = 2Na3.
7. التحلل عند التسخين :
Ca (OH) 2 \u003d CaO + H 2 O.
يرجى ملاحظة أن هيدروكسيدات الفلزات القلوية، باستثناء الليثيوم، لا تشارك في مثل هذه التفاعلات.
!!!هل توجد أمطار قلوية؟!!! نعم يوجد، لكنها ليست شائعة مثل أمطار حمضية، غير معروفة، وتأثيرها على الأشياء بيئةغير مستكشفة عمليا. ومع ذلك، فإن النظر فيها يستحق الاهتمام.
يمكن تفسير أصل الترسيب القلوي على النحو التالي.
كربونات الكالسيوم 3 → كربونات الكالسيوم + ثاني أكسيد الكربون 2
في الغلاف الجوي، يتحد أكسيد الكالسيوم مع بخار الماء أثناء تكثيفهما، مع المطر أو الصقيع، مكونًا هيدروكسيد الكالسيوم:
CaO + H2O → Ca (OH) 2،
مما يخلق رد فعل قلوي تساقط. في المستقبل من الممكن تفاعل هيدروكسيد الكالسيوم مع ثاني أكسيد الكربون والماء لتكوين كربونات الكالسيوم وبيكربونات الكالسيوم:
Ca (OH) 2 + CO 2 → CaCO 3 + H 2 O؛
CaCO 3 + CO 2 + H 2 O → Ca (HC0 3) 2.
أظهر التحليل الكيميائي لمياه الأمطار أنها تحتوي على كميات قليلة من أيونات الكبريتات والنترات (حوالي 0.2 ملغم/لتر). من المعروف أن أحماض الكبريتيك والنيتريك تسبب هطولًا حمضيًا. وفي الوقت نفسه، هناك نسبة عالية من كاتيونات الكالسيوم (5-8 ملغم / لتر) وأيونات البيكربونات، والتي يكون محتواها في مجال بناء المؤسسات المعقدة أعلى بمقدار 1.5-2 مرات منه في المناطق الأخرى المدينة، وتبلغ 18-24 ملغم/لتر. وهذا يدل على أنه في تشكيل هطول الأمطار القلوية المحلية دور قيادييلعب نظام كربونات الكالسيوم والعمليات التي تحدث فيه كما ذكرنا أعلاه.
يؤثر هطول الأمطار القلوية على النباتات، ويلاحظ التغيرات في التركيب المظهري للنباتات. توجد آثار "حروق" على شفرات الأوراق، طلاء أبيضعلى الأوراق والحالة المظلومة للنباتات العشبية.
الأملاح هي نتاج استبدال ذرات الهيدروجين في الحمض بمعدن. تنفصل الأملاح القابلة للذوبان في الصودا إلى كاتيون معدني وأنيون بقايا حمض. وتنقسم الأملاح إلى:
واسطة
أساسي
معقد
مزدوج
مختلط
أملاح متوسطة.هذه هي منتجات الاستبدال الكامل لذرات الهيدروجين في حمض بذرات فلز، أو مع مجموعة من الذرات (NH 4 +): MgSO 4، Na 2 SO 4، NH 4 Cl، Al 2 (SO 4) 3.
أسماء الأملاح الوسطى تأتي من أسماء المعادن والأحماض: CuSO 4 - كبريتات النحاس، Na 3 PO 4 - فوسفات الصوديوم، NaNO 2 - نتريت الصوديوم، NaClO - هيبوكلوريت الصوديوم، NaClO 2 - كلوريت الصوديوم، NaClO 3 - كلورات الصوديوم. ، NaClO 4 - بيركلورات الصوديوم، CuI - يوديد النحاس (I)، CaF 2 - فلوريد الكالسيوم. تحتاج أيضًا إلى تذكر بعض الأسماء التافهة: ملح الطعام NaCl، KNO3- نترات البوتاسيوم، K2CO3-البوتاسيوم، Na2CO3-رماد الصودا، Na2CO3∙10H2O-صودا بلورية، CuSO4-كبريتات النحاس،Na 2 B 4 O 7. . 10H2 O- البوراكس، Na2SO4 . 10H2 ملح O-جلوبر. أملاح مزدوجة.هذا ملح تحتوي على نوعين من الكاتيونات (ذرات الهيدروجين multibasicيتم استبدال الأحماض بكاتيونات مختلفة: MgNH 4 ص 4، كال (SO 4) 2، ناكسو 4 الأملاح المزدوجة كمركبات فردية توجد فقط في شكل بلوري. عندما تذوب في الماء، فهي كاملةتنأى إلى أيونات معدنية وبقايا حمض (إذا كانت الأملاح قابلة للذوبان)، على سبيل المثال:
NaKSO 4 ↔ Na + + K + + SO 4 2-
من الجدير بالذكر أن تفكك الأملاح المزدوجة في المحاليل المائية يتم في خطوة واحدة. لتسمية الأملاح من هذا النوع، عليك معرفة أسماء الأنيون والكاتيونات: MgNH4PO4 - فوسفات الأمونيوم المغنيسيوم.
أملاح معقدة.هذه هي الجزيئات (جزيئات محايدة أوالأيونات ) والتي تتشكل نتيجة الانضمام إلى هذاالأيون (أو الذرة) )، مُسَمًّى عامل تعقيد، تسمى الجزيئات المحايدة أو الأيونات الأخرى بروابط. تنقسم الأملاح المعقدة إلى:
1) مجمعات الكاتيون
Cl 2 - ثنائي كلوريد رباعي أمينزينك (II).
Cl2-دي كلوريد سداسي أمين كوبالت (II).
2) مجمعات أنيون
ك2- رباعي فلوروبيريلات البوتاسيوم (II)
لي-رباعي هيدرو ألومينات الليثيوم (III)
ك3-هيكسسيانوفيرات البوتاسيوم (III)
تم تطوير نظرية بنية المركبات المعقدة بواسطة الكيميائي السويسري أ. فيرنر.
أملاح حمضيةهي منتجات الاستبدال غير الكامل لذرات الهيدروجين في الأحماض متعددة القاعدة للكاتيونات المعدنية.
على سبيل المثال: NaHCO3
الخواص الكيميائية:
تتفاعل مع المعادن في سلسلة الجهد على يسار الهيدروجين.
2KHSO4 + ملغم → H2 + ملغم (SO) 4 + K2 (SO) 4
لاحظ أنه بالنسبة لمثل هذه التفاعلات، من الخطر تناول الفلزات القلوية، لأنها ستتفاعل أولاً مع الماء مع إطلاق كمية كبيرة من الطاقة، وسيحدث انفجار، لأن جميع التفاعلات تحدث في المحاليل.
2NaHCO 3 + Fe → H 2 + Na 2 CO 3 + Fe 2 (CO 3) 3 ↓
تتفاعل الأملاح الحمضية مع المحاليل القلوية لتكوين الملح (الأملاح) الوسطى والماء:
NaHCO 3 + NaOH → Na 2 CO 3 + H 2 O
2KHSO 4 +2NaOH→2H 2 O+K 2 SO 4 +Na 2 SO 4
تتفاعل الأملاح الحمضية مع محاليل الأملاح المتوسطة إذا تحرر غاز أو راسب أو تحرر ماء:
2KHSO 4 + MgCO 3 → MgSO 4 + K 2 SO 4 + CO 2 + H 2 O
2KHSO 4 +BaCl 2 →BaSO 4 ↓+K 2 SO 4 +2HCl
تتفاعل الأملاح الحمضية مع الأحماض إذا كان الناتج الحمضي للتفاعل أضعف أو أكثر تطايرًا من الناتج المضاف.
NaHCO3 +HCl→NaCl+CO2 +H2O
تتفاعل الأملاح الحمضية مع الأكاسيد الأساسية مع إطلاق الماء والأملاح المتوسطة:
2NaHCO 3 + MgO → MgCO 3 ↓ + Na 2 CO 3 + H 2 O
2KHSO 4 + BeO → BeSO 4 + K 2 SO 4 + H 2 O
تتحلل الأملاح الحمضية (خاصة الهيدروكربونات) تحت تأثير درجة الحرارة:
2NaHCO 3 → Na2CO3 + CO2 + H2O
إيصال:
تتشكل الأملاح الحمضية عندما تتعرض القلويات لفائض من محلول حمض متعدد القاعدة (تفاعل التعادل):
هيدروكسيد الصوديوم + H2SO4 → NaHSO4 + H2O
ملغ (OH) 2 + 2H 2 SO 4 → ملغ (H SO 4) 2 + 2 H 2 O
تتشكل الأملاح الحمضية عن طريق إذابة الأكاسيد الأساسية في الأحماض المتعددة القاعدة:
MgO + 2H2SO4 → Mg (HSO4) 2 + H2O
تتشكل الأملاح الحمضية عندما تذوب المعادن في كمية زائدة من محلول حمض متعدد القاعدة:
ملغ + 2H 2 SO 4 → ملغ (H SO 4) 2 + H 2
تتشكل الأملاح الحمضية نتيجة تفاعل الملح المتوسط مع الحمض الذي يشكل أنيون الملح المتوسط:
Ca 3 (أ ف ب 4) 2 + ح 3 ص 4 → 3CaHPO 4
الأملاح الأساسية:
الأملاح الأساسية هي نتاج الاستبدال غير الكامل لمجموعة الهيدروكسو في جزيئات القواعد متعددة الأحماض لبقايا الحمض.
مثال: MgOHNO 3 ,FeOHCl.
الخواص الكيميائية:
تتفاعل الأملاح القاعدية مع الحمض الزائد لتكوين ملح متوسط وماء.
MgOHNO 3 + HNO 3 → Mg (NO 3) 2 + H 2 O
تتحلل الأملاح الأساسية حسب درجة الحرارة:
2 CO 3 →2CuO + CO 2 + H 2 O
الحصول على الأملاح الأساسية:
تفاعل أملاح الأحماض الضعيفة مع الأملاح المتوسطة:
2MgCl 2 + 2Na 2 CO 3 + H 2 O → 2 CO 3 + CO 2 + 4 NaCl
التحلل المائي للأملاح التي تتكون من قاعدة ضعيفة وحمض قوي:
ZnCl 2 + H 2 O → Cl + HCl
معظم الأملاح الأساسية قابلة للذوبان بشكل طفيف. والعديد منها عبارة عن معادن، على سبيل المثال الملكيت Cu 2 CO 3 (OH) 2 وهيدروكسيلاباتيت Ca 5 (PO 4) 3 OH.
لم تتم تغطية خصائص الأملاح المختلطة في مقرر الكيمياء المدرسي، ولكن من المهم معرفة التعريف.
الأملاح المختلطة هي أملاح ترتبط فيها البقايا الحمضية لحمضين مختلفين بكاتيون معدني واحد.
وخير مثال على ذلك هو Ca(OCl)Cl المبيض (المبيض).
التسميات:
1. يحتوي الملح على كاتيون معقد
أولاً، يتم تسمية الكاتيون، ثم تدخل الأنيونات والروابط إلى المجال الداخلي، وتنتهي بالحرف "o" ( Cl - - كلورو، OH - -hydroxo)، ثم الروابط، وهي جزيئات متعادلة ( NH 3 - أمين، H 2 O -aquo). إذا كان هناك أكثر من 1 بروابط متطابقة، تتم الإشارة إلى عددها بالأرقام اليونانية: 1 - أحادي، 2 - دي، 3 - ثلاثة، 4 - رباعي، 5 - بنتا، 6 - سداسي، 7 - سباعي، 8 - أوكتا، 9 - نونا، 10 - عشاري. ويسمى الأخير أيون التعقيد، مما يدل على تكافؤه بين قوسين، إذا كان متغيرا.
[ حج (NH 3 ) 2 ] (OH ) - هيدروكسيد ديامين الفضة (أنا)
[ Co (NH 3 ) 4 Cl 2 ] Cl 2 - ثنائي كلورو كلوريد o رباعي أمين الكوبالت (ثالثا)
2. يحتوي الملح على أنيون معقد.
أولاً، يتم تسمية الروابط الأنيونية، ثم الجزيئات المحايدة التي تدخل المجال الداخلي وتنتهي بالحرف "o"، مما يشير إلى عددها بالأرقام اليونانية.يُطلق على الأخير اسم أيون التعقيد باللاتينية، مع اللاحقة "at"، للإشارة إلى التكافؤ بين قوسين. بعد ذلك، يتم كتابة اسم الكاتيونات الموجودة في المجال الخارجي، ولم تتم الإشارة إلى عدد الكاتيونات.
K4 -هيكساسيانوفيرات (II) البوتاسيوم (كاشف لأيونات الحديد 3+)
K 3 - هيكسسيانوفيرات البوتاسيوم (III) (كاشف لأيونات الحديد 2+)
نا 2 - رباعي هيدروكسيزينات الصوديوم
معظم الأيونات المعقدة هي معادن. يظهر الميل الأكبر للتكوين المعقد بواسطة العناصر d. يوجد حول أيون المعقد المركزي أيونات مشحونة بشكل معاكس أو جزيئات محايدة - بروابط أو إضافات.
يشكل الأيون المعقد والروابط المجال الداخلي للمجمع (بين قوسين مربعين)، ويسمى عدد الروابط المنسقة حول الأيون المركزي برقم التنسيق.
الأيونات التي لا تدخل المجال الداخلي تشكل المجال الخارجي. إذا كان الأيون المركب عبارة عن كاتيون، فهناك أنيونات في المجال الخارجي والعكس صحيح، إذا كان الأيون المركب أنيونًا، فهناك كاتيونات في المجال الخارجي. الكاتيونات عادة ما تكون أيونات المعادن الأرضية القلوية والقلوية، كاتيون الأمونيوم. عند انفصالها، تعطي المركبات المعقدة أيونات معقدة تكون مستقرة تمامًا في المحاليل:
ك 3 ↔3ك + + 3-
إذا كنا نتحدث عن الأملاح الحمضية، فعند قراءة الصيغة، يتم نطق البادئة المائية، على سبيل المثال:
هيدروكبريتيد الصوديوم NaHS
بيكربونات الصوديوم NaHCO3
مع الأملاح الأساسية، يتم استخدام البادئة هيدروكسي-أو ثنائي هيدروكسو-
(يعتمد على درجة أكسدة المعدن الموجود في الملح)، على سبيل المثال:
هيدروكسيوكلوريد المغنيسيومMg(OH)Cl، ثنائي هيدروكلوريد الألومنيوم Al(OH)2 Cl
طرق الحصول على الأملاح:
1. التفاعل المباشر للمعادن مع غير المعدنية . وبهذه الطريقة يمكن الحصول على أملاح أحماض الأكسجين.
الزنك+الكلور 2 → الزنككل 2
2. التفاعل بين الحمض والقاعدة (تفاعل التعادل). ردود الفعل من هذا النوع لديها كبيرة قيمة عملية (ردود الفعل النوعيةبالنسبة لمعظم الكاتيونات)، تكون مصحوبة دائمًا بإطلاق الماء:
هيدروكسيد الصوديوم+حمض الهيدروكلوريك→NaCl+H2O
Ba(OH) 2 + H2 SO 4 → BaSO 4 ↓ + 2H 2 O
3. تفاعل الأكسيد الأساسي مع الحمض :
SO 3 + BaO → BaSO 4 ↓
4. تفاعل أكسيد الحمض والقاعدة :
2NaOH + 2NO 2 → NaNO 3 + NaNO 2 + H 2 O
NaOH + CO 2 →Na 2 CO 3 +H 2 O
5. تفاعل الأكسيد الأساسي والحمض :
Na2O + 2HCl → 2NaCl + H2O
CuO + 2HNO 3 \u003d Cu (NO 3) 2 + H 2 O
6. التفاعل المباشر للمعادن مع الحمض. قد يكون هذا التفاعل مصحوبًا بتطور الهيدروجين. يعتمد إطلاق الهيدروجين أم لا على نشاط المعدن، والخواص الكيميائية للحمض وتركيزه (انظر خصائص أحماض الكبريتيك والنيتريك المركزة).
Zn + 2HCl \u003d ZnCl 2 + H 2
ح 2 SO 4 + Zn \u003d ZnSO 4 + H 2
7. تفاعل الملح مع الحمض . سيحدث هذا التفاعل بشرط أن يكون الحمض الذي يشكل الملح أضعف أو أكثر تطايرًا من الحمض الذي تفاعل:
Na 2 CO 3 + 2HNO 3 \u003d 2NaNO 3 + CO 2 + H 2 O
8. تفاعل الملح مع أكسيد الحمض . تحدث التفاعلات فقط عند تسخينها، لذلك يجب أن يكون الأكسيد المتفاعل أقل تطايرًا من الأكسيد المتكون بعد التفاعل:
CaCO 3 + SiO 2 \u003d CaSiO 3 + CO 2
9. تفاعل اللافلز مع القلوي . الهالوجينات والكبريت وبعض العناصر الأخرى التي تتفاعل مع القلويات تعطي أملاحًا خالية من الأكسجين وتحتوي على الأكسجين:
Cl 2 + 2KOH \u003d KCl + KClO + H 2 O (يستمر التفاعل بدون تسخين)
Cl 2 + 6KOH \u003d 5KCl + KClO 3 + 3H 2 O (يستمر التفاعل بالتسخين)
3S + 6NaOH \u003d 2Na 2 S + Na 2 SO 3 + 3H 2 O
10. التفاعل بين اثنين من الأملاح. هذه هي الطريقة الأكثر شيوعًا للحصول على الأملاح. ولهذا يجب أن يكون كلا الأملاح التي دخلت التفاعل شديدة الذوبان، وبما أن هذا تفاعل تبادل أيوني، لكي يصل إلى النهاية، يجب أن يكون أحد منتجات التفاعل غير قابل للذوبان:
Na 2 CO 3 + CaCl 2 \u003d 2NaCl + CaCO 3 ↓
نا 2 SO 4 + BaCl 2 \u003d 2NaCl + BaSO 4 ↓
11. التفاعل بين الملح والمعادن . يستمر التفاعل إذا كان المعدن في سلسلة جهد المعادن الموجودة على يسار تلك الموجودة في الملح:
Zn + CuSO 4 \u003d ZnSO 4 + Cu ↓
12. التحلل الحراري للأملاح . عند تسخين بعض الأملاح المحتوية على الأكسجين، تتكون أملاح جديدة ذات محتوى أكسجين أقل، أو لا تحتوي عليه على الإطلاق:
2كنو 3 → 2كنو 2 + يا 2
4KClO 3 → 3KClO 4 + بوكل
2KClO 3 → 3O 2 +2KCl
13. تفاعل اللافلزات مع الملح. بعض اللافلزات قادرة على الاتحاد مع الأملاح لتكوين أملاح جديدة:
Cl 2 +2KI=2KCl+I 2 ↓
14. تفاعل القاعدة مع الملح . نظرًا لأن هذا تفاعل تبادل أيوني، فمن الضروري أن يكون أحد منتجات التفاعل غير قابل للذوبان حتى يصل إلى النهاية (يُستخدم هذا التفاعل أيضًا لترجمة أملاح حمضيةفي المنتصف):
FeCl 3 + 3NaOH \u003d Fe (OH) 3 ↓ + 3NaCl
NaOH+ZnCl 2 = (ZnOH)Cl+NaCl
KHSO 4 + KOH \u003d K 2 SO 4 + H 2 O
وبنفس الطريقة يمكن الحصول على أملاح مزدوجة:
هيدروكسيد الصوديوم + KHSO 4 \u003d KNaSO 4 + H 2 O
15. تفاعل المعدن مع القلويات. تتفاعل المعادن المذبذبة مع القلويات لتشكل معقدات:
2Al+2NaOH+6H 2O=2Na+3H 2
16. تفاعل الأملاح (أكاسيد وهيدروكسيدات ومعادن) مع الروابط:
2Al+2NaOH+6H 2O=2Na+3H 2
AgCl+3NH4OH=OH+NH4Cl+2H2O
3K 4 + 4FeCl 3 \u003d Fe 3 3 + 12KCl
AgCl+2NH4OH=Cl+2H2O
المحرر: خارلاموفا جالينا نيكولاييفنا
أملاحتسمى المواد المعقدة التي تتكون جزيئاتها من ذرات معدنية وبقايا حمض (في بعض الأحيان قد تحتوي على الهيدروجين). على سبيل المثال، NaCl هو كلوريد الصوديوم، CaSO 4 هو كبريتات الكالسيوم، وما إلى ذلك.
عمليا جميع الأملاح عبارة عن مركبات أيونيةلذلك، في الأملاح، تكون أيونات بقايا الأحماض وأيونات المعادن مترابطة:
Na + Cl - - كلوريد الصوديوم
Ca 2+ SO 4 2– - كبريتات الكالسيوم، إلخ.
الملح هو نتاج الاستبدال الجزئي أو الكامل لذرات الهيدروجين الحمضية بمعدن. ومن هنا يتم تمييز الأنواع التالية من الأملاح:
1. الأملاح المتوسطة- يتم استبدال جميع ذرات الهيدروجين الموجودة في الحمض بمعدن: Na 2 CO 3، KNO 3، إلخ.
2. الأملاح الحمضية- لا يتم استبدال جميع ذرات الهيدروجين الموجودة في الحمض بمعدن. وبطبيعة الحال، يمكن للأملاح الحمضية أن تشكل فقط أحماض ديباسيك أو بوليباسيك. لا يمكن للأحماض الأحادية القاعدة أن تعطي أملاحًا حمضية: NaHCO 3، NaH 2 PO 4، إلخ. د.
3. أملاح مزدوجة- لا يتم استبدال ذرات الهيدروجين في حمض ثنائي القاعدة أو متعدد القاعدة بمعدن واحد، بل بمعدنين مختلفين: NaKCO 3، KAl(SO 4) 2، إلخ.
4. الأملاح الأساسيةيمكن اعتبارها منتجات استبدال غير كامل أو جزئي لمجموعات الهيدروكسيل من القواعد بواسطة المخلفات الحمضية: Al(OH)SO 4 , Zn(OH)Cl، إلخ.
وفقًا للتسميات الدولية، يأتي اسم ملح كل حمض الاسم اللاتينيعنصر.على سبيل المثال، تسمى أملاح حمض الكبريتيك الكبريتات: CaSO 4 - كبريتات الكالسيوم، Mg SO 4 - كبريتات المغنيسيوم، وما إلى ذلك؛ تسمى أملاح حمض الهيدروكلوريك بالكلوريدات: NaCl - كلوريد الصوديوم، ZnCI 2 - كلوريد الزنك، إلخ.
يضاف جسيم "ثنائي" أو "هيدرو" إلى اسم أملاح الأحماض الثنائية القاعدة: Mg (HCl 3) 2 - بيكربونات المغنسيوم أو بيكربونات.
بشرط أنه في حمض التريباسيك يتم استبدال ذرة هيدروجين واحدة فقط بمعدن، ثم تتم إضافة البادئة "ثنائي هيدرو": NaH 2 PO 4 - فوسفات ثنائي هيدروجين الصوديوم.
الأملاح هي مواد صلبة لها نطاق واسع من الذوبان في الماء.
 الخواص الكيميائية للأملاح
الخواص الكيميائية للأملاح
يتم تحديد الخواص الكيميائية للأملاح من خلال خصائص الكاتيونات والأنيونات التي تشكل جزءًا من تركيبها.
1. بعض تتحلل الأملاح عند المكلس:
CaCO 3 \u003d CaO + CO 2
2. تتفاعل مع الأحماضلتكوين ملح جديد وحمض جديد. ولكي يحدث هذا التفاعل من الضروري أن يكون الحمض أقوى من الملح الذي يعمل عليه الحمض:
2NaCl + H2SO4 → Na2SO4 + 2HCl.
3. التفاعل مع القواعدوتشكيل ملح جديد وقاعدة جديدة:
Ba(OH) 2 + MgSO 4 → BaSO 4 ↓ + Mg(OH) 2 .
4. التفاعل مع بعضهم البعضمع تكوين أملاح جديدة:
كلوريد الصوديوم + AgNO 3 → AgCl + NaNO 3 .
5. التفاعل مع المعادن،والتي تكون في نطاق نشاط المعدن الذي يشكل جزءاً من الملح:
Fe + CuSO4 → FeSO4 + Cu↓.
هل لديك اسئلة؟ هل تريد معرفة المزيد عن الأملاح؟
للحصول على مساعدة المعلم - قم بالتسجيل.
الدرس الأول مجاني!
الموقع، مع النسخ الكامل أو الجزئي للمادة، مطلوب رابط للمصدر.
1. الأملاح هي إلكتروليتات.
في المحاليل المائية، تنفصل الأملاح إلى أيونات معدنية موجبة الشحنة (كاتيونات) وأيونات سالبة الشحنة (أنيونات) من بقايا الحمض.
على سبيل المثالعندما تذوب بلورات كلوريد الصوديوم في الماء، تدخل أيونات الصوديوم الموجبة الشحنة وأيونات الكلوريد المشحونة سالبة الشحنة، والتي تتكون منها الشبكة البلورية لهذه المادة، إلى المحلول:
كلوريد الصوديوم → كلوريد الصوديوم - .
أثناء التفكك الكهربي لكبريتات الألومنيوم، تتشكل أيونات الألومنيوم المشحونة إيجابيًا وأيونات الكبريتات سالبة الشحنة:
آل 2 سو 4 3 → 2 آل 3 3 سو 4 2 - .
2. يمكن للأملاح أن تتفاعل مع المعادن.
في سياق تفاعل الاستبدال الذي يحدث في محلول مائي، يحل معدن أكثر نشاطًا كيميائيًا محل معدن أقل نشاطًا.
على سبيل المثالإذا وضعت قطعة من الحديد في محلول من كبريتات النحاس فإنها تغطى براسب بني محمر من النحاس. يتغير لون المحلول تدريجيًا من الأزرق إلى الأخضر الفاتح نتيجة لتكوين ملح الحديد (\ (II \)):
الحديد النحاس SO 4 → الحديد SO 4 النحاس ↓ .
مقطع فيديو:
عندما يتفاعل كلوريد النحاس (\ (II \)) مع الألومنيوم، يتكون كلوريد الألومنيوم والنحاس:
2 Al 3Cu Cl 2 → 2Al Cl 3 3 Cu ↓ .
3. يمكن للأملاح أن تتفاعل مع الأحماض.
يحدث تفاعل تبادلي، حيث يحل حمض أكثر نشاطًا كيميائيًا محل حمض أقل نشاطًا.
على سبيل المثالعند تفاعل محلول كلوريد الباريوم مع حمض الكبريتيك يتكون راسب من كبريتات الباريوم ويبقى حمض الهيدروكلوريك في المحلول:
BaCl 2 H 2 SO 4 → Ba SO 4 ↓ 2 حمض الهيدروكلوريك.
عندما تتفاعل كربونات الكالسيوم مع حمض الهيدروكلوريك، يتكون كلوريد الكالسيوم وحمض الكربونيك، والذي يتحلل على الفور إلى ثاني أكسيد الكربون والماء:
CaCO 3 2 حمض الهيدروكلوريك → CaCl 2 H 2 O CO 2 H 2 CO 3 .
مقطع فيديو:
4. يمكن للأملاح القابلة للذوبان في الماء أن تتفاعل مع القلويات.
يكون تفاعل التبادل ممكنًا إذا كان واحد على الأقل من المنتجات، نتيجة لذلك، غير قابل للذوبان عمليًا (يترسب).
على سبيل المثال، عندما تتفاعل نترات النيكل (\ (II \)) مع هيدروكسيد الصوديوم، تتشكل نترات الصوديوم وهيدروكسيد النيكل غير القابل للذوبان عمليا (\ (II \)):
ني NO 3 2 2 NaOH → Ni OH 2 ↓ 2Na NO 3.
مقطع فيديو:
عندما تتفاعل كربونات الصوديوم (الصودا) مع هيدروكسيد الكالسيوم (الجير المطفأ)، يتكون هيدروكسيد الصوديوم وكربونات الكالسيوم غير القابلة للذوبان عمليا:
Na 2 CO 3 CaOH 2 → 2NaOH CaCO 3 ↓.
5. يمكن أن تدخل الأملاح القابلة للذوبان في الماء في تفاعل تبادلي مع أملاح أخرى قابلة للذوبان في الماء إذا تشكلت نتيجة لذلك مادة واحدة غير قابلة للذوبان عمليا.
على سبيل المثال، عندما يتفاعل كبريتيد الصوديوم مع نترات الفضة، يتم تشكيل نترات الصوديوم وكبريتيد الفضة غير القابلة للذوبان عمليا:
Na 2 S 2Ag NO 3 → Na NO 3 Ag 2 S ↓.
مقطع فيديو:
عندما تتفاعل نترات الباريوم مع كبريتات البوتاسيوم، يتم تشكيل نترات البوتاسيوم وكبريتات الباريوم غير القابلة للذوبان عمليا:
با NO 3 2 K 2 SO 4 → 2 KNO 3 BaSO 4 ↓ .
6. تتحلل بعض الأملاح عند تسخينها.
علاوة على ذلك، يمكن تقسيم التفاعلات الكيميائية التي تحدث في هذه الحالة إلى مجموعتين:
- التفاعلات التي لا تتغير فيها العناصر من حالة الأكسدة
- تفاعلات الأكسدة والاختزال.
أ.تفاعلات تحلل الملح التي تحدث دون تغيير حالة أكسدة العناصر.
كأمثلة على ذلك التفاعلات الكيميائيةدعونا نفكر في كيفية استمرار تحلل الكربونات.
عند تسخينها بقوة تتحلل كربونات الكالسيوم (الطباشير والحجر الجيري والرخام) لتشكل أكسيد الكالسيوم (الجير المحروق) وثاني أكسيد الكربون:
CaCO 3 طن درجة CaO CO 2 .
مقطع فيديو:
بيكربونات الصوديوم ( صودا الخبز) مع تسخين طفيف يتحلل إلى كربونات الصوديوم (الصودا) والماء وثاني أكسيد الكربون:
2 NaHCO 3 t ° Na 2 CO 3 H 2 O CO 2 .
مقطع فيديو:
هيدرات الأملاح البلورية تفقد الماء عند تسخينها. على سبيل المثال، كبريتات النحاس الخماسي الهيدرات (\ (II \)) (كبريتات النحاس)، التي تفقد الماء تدريجياً، تتحول إلى كبريتات النحاس اللامائية (\ (II \)):
CuSO 4 ⋅ 5 H 2 O → t ° CuSO 4 5 H 2 O.
في ظل الظروف العادية، يمكن تحويل كبريتات النحاس اللامائية المتكونة إلى هيدرات بلورية:
CuSO · 4 · 5 H 2 O → CuSO 4 ⋅ 5 H 2 O
مقطع فيديو:
تدمير وتكوين كبريتات النحاس |
أسس – مواد معقدة تتكون من كاتيون معدني Me + (أو كاتيون يشبه المعدن، على سبيل المثال، أيون الأمونيوم NH 4 +) وأنيون هيدروكسيد OH -.
وتقسم القواعد حسب قابليتها للذوبان في الماء إلى: قابل للذوبان (القلوي) و قواعد غير قابلة للذوبان . لديه أيضا أسباب غير مستقرةالتي تتحلل تلقائيا.
الحصول على الأسباب
1. تفاعل الأكاسيد الأساسية مع الماء. وفي الوقت نفسه، فإنها تتفاعل مع الماء في الظروف العادية فقط تلك الأكاسيد التي تتوافق مع قاعدة قابلة للذوبان (القلويات).أولئك. بهذه الطريقة يمكنك الحصول فقط القلويات:
أكسيد أساسي + ماء = قاعدة
على سبيل المثال , أكسيد الصوديومأشكال في الماء هيدروكسيد الصوديوم(هيدروكسيد الصوديوم):
نا 2 O + H 2 O → 2NaOH
في نفس الوقت عنه أكسيد النحاس (II).مع ماء لا يتفاعل:
CuO + H2O ≠
2. تفاعل المعادن مع الماء. حيث تتفاعل مع الماءفي ظل ظروف طبيعيةالمعادن القلوية فقط(الليثيوم، الصوديوم، البوتاسيوم، الروبيديوم، السيزيوم)والكالسيوم والسترونتيوم والباريوم.في هذه الحالة، يحدث تفاعل الأكسدة والاختزال، حيث يعمل الهيدروجين كعامل مؤكسد، ويعمل المعدن كعامل اختزال.
فلز + ماء = قلوي + هيدروجين
على سبيل المثال, البوتاسيوميتفاعل مع ماء عنيفة جدا:
2K 0 + 2H 2 + O → 2K + OH + H 2 0


3. التحليل الكهربائي لمحاليل بعض أملاح الفلزات القلوية. كقاعدة عامة، للحصول على القلويات، يخضع للتحليل الكهربائي محاليل الأملاح المتكونة من الفلزات القلوية أو القلوية الأرضية والأحماض الأكسجينية (باستثناء الهيدروفلوريك) - الكلوريدات والبروميدات والكبريتيدات وما إلى ذلك. تمت مناقشة هذه المشكلة بمزيد من التفصيل في المقالة .
على سبيل المثال , التحليل الكهربائي لكلوريد الصوديوم:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
4. تتشكل القواعد من تفاعل القلويات الأخرى مع الأملاح. في هذه الحالة، تتفاعل المواد القابلة للذوبان فقط، ويجب أن يتكون ملح غير قابل للذوبان أو قاعدة غير قابلة للذوبان في المنتجات:
أو
غسول + ملح 1 = ملح 2 ↓ + غسول
على سبيل المثال: يتفاعل كربونات البوتاسيوم في المحلول مع هيدروكسيد الكالسيوم:
K 2 CO 3 + Ca(OH) 2 → CaCO 3 ↓ + 2KOH
على سبيل المثال: يتفاعل كلوريد النحاس (II) في المحلول مع هيدروكسيد الصوديوم. وبنفس الوقت يسقط راسب أزرق من هيدروكسيد النحاس الثنائي:
CuCl 2 + 2NaOH → Cu(OH) 2 ↓ + 2NaCl

الخواص الكيميائية للقواعد غير القابلة للذوبان
1. القواعد غير القابلة للذوبان تتفاعل مع الأحماض القوية وأكاسيدها (وبعض الأحماض المتوسطة). وفي نفس الوقت تتشكل الملح والماء.
قاعدة غير قابلة للذوبان + حمض = ملح + ماء
قاعدة غير قابلة للذوبان + أكسيد الحمض= ملح + ماء
على سبيل المثال ,يتفاعل هيدروكسيد النحاس (II) مع حمض الهيدروكلوريك القوي:
Cu(OH) 2 + 2HCl = CuCl 2 + 2H2O
في هذه الحالة، لا يتفاعل هيدروكسيد النحاس (II) مع الأكسيد الحمضي ضعيفحمض الكربونيك - ثاني أكسيد الكربون:
النحاس (OH) 2 + CO 2 ≠
2. تتحلل القواعد غير القابلة للذوبان عند تسخينها إلى أكسيد وماء.
على سبيل المثال, يتحلل هيدروكسيد الحديد (III) إلى أكسيد الحديد (III) والماء عند المكلس:
2Fe(OH) 3 = الحديد 2 O 3 + 3H 2 O
3. القواعد غير القابلة للذوبان لا تتفاعلمع أكاسيد وهيدروكسيدات مذبذبة.
قاعدة غير قابلة للذوبان + أكسيد مذبذب ≠
قاعدة غير قابلة للذوبان + هيدروكسيد مذبذب ≠
4. بعض القواعد غير القابلة للذوبان يمكن أن تكون بمثابةتقليل الوكلاء. عوامل الاختزال هي قواعد مكونة من معادن مع الحد الأدنىأو حالة الأكسدة المتوسطة، والتي يمكن أن تزيد من حالة الأكسدة (هيدروكسيد الحديد (II)، هيدروكسيد الكروم (II)، وما إلى ذلك).
على سبيل المثال ، يمكن أكسدة هيدروكسيد الحديد (II) مع الأكسجين الجوي في وجود الماء إلى هيدروكسيد الحديد (III):
4Fe +2 (OH) 2 + O 2 0 + 2H 2 O → 4Fe +3 (O -2 H) 3
الخواص الكيميائية للقلويات
1. القلويات تتفاعل مع أي الأحماض - القوية والضعيفة . في هذه الحالة، يتم تشكيل الملح والماء. وتسمى ردود الفعل هذه تفاعلات التعادل. وربما التعليم الملح الحمضي، إذا كان الحمض متعدد القاعدة، عند نسبة معينة من الكواشف، أو في حمض زائد. في القلويات الزائدةيتكون متوسط الملح والماء:
القلويات (الزائدة) + الحمض \u003d ملح متوسط + ماء
قلوي + حمض متعدد القاعدة (زائد) = ملح حمض + ماء
على سبيل المثال , عند تفاعل هيدروكسيد الصوديوم مع حمض الفوسفوريك التريباسيك، يمكن أن يشكل ثلاثة أنواع من الأملاح: ثنائي هيدروفوسفات, الفوسفاتأو الهيدروفوسفات.
في هذه الحالة، تتشكل مركبات ثنائي هيدرو الفوسفات بكمية زائدة من الحمض، أو بنسبة مولية (نسبة كميات المواد) للكواشف 1:1.
NaOH + H3PO4 → NaH2PO4 + H2O
مع النسبة المولية لكمية القلويات والحمض 2: 1، تتشكل الهيدروفوسفات:
2NaOH + H3PO4 → Na2HPO4 + 2H2O
عند زيادة القلويات، أو عند نسبة مولية للقلويات والحمض 3:1، يتكون فوسفات فلز قلوي.
3NaOH + H3PO4 → Na3PO4 + 3H2O


2. تتفاعل القلويات معهاأكاسيد وهيدروكسيدات مذبذبة. حيث تتشكل الأملاح الشائعة في الذوبان ، أ في الحل - الأملاح المعقدة .
قلوي (منصهر) + أكسيد مذبذب = ملح متوسط + ماء
غسول + هيدروكسيد مذبذب = ملح متوسط + ماء
قلوي (محلول) + أكسيد مذبذب = ملح معقد
قلوي (محلول) + هيدروكسيد مذبذب = ملح معقد
على سبيل المثال , عندما يتفاعل هيدروكسيد الألومنيوم مع هيدروكسيد الصوديوم في الذوبان يتم تشكيل ألومينات الصوديوم. يشكل الهيدروكسيد الأكثر حمضية بقايا حمضية:
NaOH + Al(OH) 3 = NaAlO 2 + 2H 2 O
أ في الحل يتكون ملح معقد:
هيدروكسيد الصوديوم + آل(OH) 3 = نا
انتبه إلى كيفية تجميع صيغة الملح المعقد:أولا نختار الذرة المركزية (لكقاعدة عامة، هو معدن من هيدروكسيد الأمفوتريك).ثم أضف إليه بروابط- في حالتنا هذه أيونات الهيدروكسيد. عادة ما يكون عدد الروابط أكبر مرتين من حالة أكسدة الذرة المركزية. لكن مجمع الألومنيوم هو استثناء، وعدد الروابط في أغلب الأحيان هو 4. نرفق الجزء الناتج بين قوسين مربعين - وهذا أيون معقد. نحدد شحنتها ونضيف العدد المطلوب من الكاتيونات أو الأنيونات من الخارج.

3. تتفاعل القلويات مع الأكاسيد الحمضية. من الممكن أن تشكل حامِضأو ملح متوسط، اعتمادًا على النسبة المولية للقلويات وأكسيد الحمض. في فائض القلويات يتكون ملح متوسط، وفي فائض الأكسيد الحمضي يتكون ملح حمضي:
القلويات (الزائدة) + أكسيد الحمض \u003d ملح متوسط + ماء
أو:
القلويات + أكسيد الحمض (الزائد) = ملح حمضي
على سبيل المثال , عند التفاعل هيدروكسيد الصوديوم الزائدمع ثاني أكسيد الكربون تتشكل كربونات الصوديوم والماء:
2NaOH + CO 2 \u003d Na 2 CO 3 + H 2 O
وعند التفاعل ثاني أكسيد الكربون الزائدمع هيدروكسيد الصوديوم يتكون بيكربونات الصوديوم فقط:
2NaOH + CO 2 = NaHCO 3
4. تتفاعل القلويات مع الأملاح. تتفاعل القلويات فقط مع الأملاح الذائبةفي الحل، بشرط تشكل المنتجات غازًا أو راسبًا . تتم هذه التفاعلات وفقًا للآلية التبادل الأيوني.
القلويات + الملح الذائب = الملح + الهيدروكسيد المقابل
تتفاعل القلويات مع محاليل الأملاح المعدنية التي تتوافق مع هيدروكسيدات غير قابلة للذوبان أو غير مستقرة.
على سبيل المثاليتفاعل هيدروكسيد الصوديوم مع كبريتات النحاس في المحلول:
Cu 2+ SO 4 2- + 2Na + OH - = Cu 2+ (OH) 2 - ↓ + Na 2 + SO 4 2-
أيضًا تتفاعل القلويات مع محاليل أملاح الأمونيوم.
على سبيل المثال , يتفاعل هيدروكسيد البوتاسيوم مع محلول نترات الأمونيوم:
NH 4 + NO 3 - + K + OH - \u003d K + NO 3 - + NH 3 + H 2 O
! عندما تتفاعل أملاح الفلزات المذبذبة مع فائض من القلويات يتكون ملح معقد!
دعونا ننظر إلى هذه المسألة بمزيد من التفصيل. وإذا كان الملح مكوناً من المعدن الذي هيدروكسيد مذبذب , يتفاعل مع كمية صغيرة من القلويات، ثم يستمر تفاعل التبادل المعتاد، ويترسبهيدروكسيد هذا المعدن .
على سبيل المثال , يتفاعل كبريتات الزنك الزائدة في المحلول مع هيدروكسيد البوتاسيوم:
ZnSO 4 + 2KOH \u003d Zn (OH) 2 ↓ + K 2 SO 4
ومع ذلك، في هذا التفاعل، لا يتم تشكيل القاعدة، ولكن هيدروكسيد مفوتيري. و كما ذكرنا أعلاه، تذوب الهيدروكسيدات المذبذبة في القلويات الزائدة لتكوين أملاح معقدة . ت وهكذا أثناء تفاعل كبريتات الزنك مع محلول قلوي زائديتكون ملح معقد ولا يتكون راسب:
ZnSO 4 + 4KOH \u003d K 2 + K 2 SO 4
وهكذا نحصل على مخططين لتفاعل الأملاح المعدنية، التي تتوافق مع هيدروكسيدات مذبذبة، مع القلويات:
ملح فلز مذبذب (زائد) + قلوي = هيدروكسيد مذبذب↓ + ملح
amph.ملح معدني + قلوي (زائد) = ملح مركب + ملح

5. تتفاعل القلويات مع الأملاح الحمضية.وفي هذه الحالة تتشكل أملاح متوسطة أو أملاح أقل حمضية.
ملح حامض + قلوي \u003d ملح متوسط + ماء
على سبيل المثال , يتفاعل هيدروكبريتيت البوتاسيوم مع هيدروكسيد البوتاسيوم لتكوين كبريتيت البوتاسيوم والماء:
KHSO 3 + KOH \u003d K 2 SO 3 + H 2 O
من السهل جدًا تحديد خصائص الأملاح الحمضية عن طريق تقسيم الملح الحمضي عقليًا إلى مادتين - حمض وملح. على سبيل المثال، نقوم بتكسير بيكربونات الصوديوم NaHCO 3 إلى حمض البوليك H 2 CO 3 وكربونات الصوديوم Na 2 CO 3 . يتم تحديد خصائص البيكربونات إلى حد كبير من خلال خصائص حمض الكربونيك وخصائص كربونات الصوديوم.
6. تتفاعل القلويات مع المعادن في المحلول وتذوب. في هذه الحالة، يحدث تفاعل الأكسدة والاختزال في المحلول ملح معقدو هيدروجين، في الذوبان - ملح متوسطو هيدروجين.
ملحوظة! فقط تلك المعادن تتفاعل مع القلويات في المحلول، حيث يكون الأكسيد ذو حالة الأكسدة الإيجابية الدنيا للمعدن مذبذبًا!
على سبيل المثال , حديدلا يتفاعل مع المحاليل القلوية، وأكسيد الحديد (II) هو القاعدة. أ الألومنيوميذوب في محلول مائي من القلويات، ويكون أكسيد الألومنيوم مذبذبا:
2Al + 2NaOH + 6H2 + O = 2Na + 3H2 0

7. القلويات تتفاعل مع اللافلزات. في هذه الحالة، تحدث تفاعلات الأكسدة والاختزال. عادة، اللافلزات غير متناسبة في القلويات. لا تتفاعلمع القلويات الأكسجين والهيدروجين والنيتروجين والكربون والغازات الخاملة (الهيليوم والنيون والأرجون وغيرها):
هيدروكسيد الصوديوم + يا 2 ≠
هيدروكسيد الصوديوم + N 2 ≠
هيدروكسيد الصوديوم+C≠
الكبريت، الكلور، البروم، اليود، الفوسفوروغيرها من غير المعادن غير متناسبفي القلويات (أي التأكسد الذاتي والإصلاح الذاتي).
على سبيل المثال، الكلورعند التفاعل مع القلويات الباردةيذهب إلى حالات الأكسدة -1 و +1:
2NaOH + Cl 2 0 \u003d NaCl - + NaOCl + + H 2 O
الكلورعند التفاعل مع الغسول الساخنيذهب إلى حالات الأكسدة -1 و +5:
6NaOH + Cl 2 0 \u003d 5NaCl - + NaCl + 5 O 3 + 3H 2 O
السيليكونيتأكسد بالقلويات إلى حالة أكسدة +4.
على سبيل المثال، في الحل:
2NaOH + Si 0 + H 2 + O \u003d NaCl - + Na 2 Si + 4 O 3 + 2H 2 0
الفلور يؤكسد القلويات:
2F 2 0 + 4NaO -2 H \u003d O 2 0 + 4NaF - + 2H 2 O
يمكنك قراءة المزيد عن ردود الفعل هذه في المقالة.

8. القلويات لا تتحلل عند تسخينها.
الاستثناء هو هيدروكسيد الليثيوم:
2LiOH \u003d Li 2 O + H 2 O