أصباغ بصرية. تتكون المنطقة البدائية للبشرة من طبقات. الرؤية ليلا ونهارا
تتركز الأصباغ البصرية في أغشية الأجزاء الخارجية. يحتوي كل قضيب على حوالي 108 جزيئات صبغية. يتم تنظيمها في عدة مئات من الأقراص المنفصلة (حوالي 750 في قضيب القرد) غير المتصلة بالغشاء الخارجي. في المخاريط، يوجد الصباغ في طيات صبغية خاصة، وهي استمرار لغشاء الخلية الخارجي لمستقبل الضوء. تشكل جزيئات الصباغ حوالي 80٪ من جميع بروتينات القرص. تكون الأصباغ البصرية معبأة بكثافة في أغشية الجزء الخارجي بحيث لا تتجاوز المسافة بين جزيئين من الصباغ البصري في القضيب 10 نانومتر. تزيد هذه التعبئة الكثيفة من احتمالية التقاط فوتون من الضوء يمر عبر طبقة من الخلايا المستقبلة للضوء. وينشأ السؤال التالي: كيف تنشأ الإشارات عندما يمتص الضوء بواسطة الصبغات البصرية؟
امتصاص الضوء بواسطة الصبغات البصريةتمت دراسة الأحداث التي تحدث عندما يمتص الضوء بواسطة صبغة القضيب، رودوبسين، باستخدام التقنيات الفسيولوجية النفسية والكيميائية الحيوية والجزيئية. يتكون جزيء الصباغ البصري من مكونين: بروتين يسمى أوبسين وكروموفور، وهو ألدهيد 11-سيس-فيتامين أ يسمى ريتينال (الشكل 1). يجب توضيح أن الكروموفور يحتوي على مجموعة كيميائية تعطي اللون للمركب. تمت دراسة الخصائص الكمية للقدرة الامتصاصية للأصباغ باستخدام القياس الطيفي. عندما تمت إضاءة رودوبسين، الصبغة البصرية للعصي، بضوء بأطوال موجية مختلفة، تم امتصاص الضوء الأزرق والأخضر بطول موجة يبلغ حوالي 500 نانومتر بشكل أفضل. تم الحصول على نتيجة مماثلة عندما تم إضاءة قضيب منفصل تحت المجهر بأشعة ضوئية ذات أطوال موجية مختلفة. تم تحديدها إدمان مثير للاهتمامبين طيف امتصاص الرودوبسين وإدراكنا لضوء الشفق. أظهرت الدراسات الفيزيائية النفسية الكمية التي أجريت على البشر أن ضوء النهار الأخضر المزرق بطول موجة يبلغ حوالي 500 نانومتر هو الأمثل لإدراك ضوء الشفق في الظلام. خلال النهار، عندما تكون العصي غير نشطة ويتم استخدام المخاريط فقط، نكون أكثر حساسية للون الأحمر الذي يتوافق مع طيف امتصاص المخاريط (سنتحدث عن هذا لاحقًا).
عندما يمتص رودوبسين فوتونًا واحدًا، تخضع شبكية العين لعملية الأيزومرية الضوئية وتنتقل من التكوين 11-cis إلى التكوين العابر. يحدث هذا الانتقال بسرعة كبيرة: في حوالي 10-12 ثانية. بعد ذلك، يخضع الجزء البروتيني من الصبغة أيضًا لسلسلة من تغييرات التحول، مع تكوين عدد من المنتجات الوسيطة. أحد أشكال جزء البروتين، الميتارودوبسين II، هو الأكثر أهمية لنقل الإشارة (سنناقش هذا لاحقًا في هذا الفصل). ويبين الشكل 2 تسلسل الأحداث أثناء التبييض وتجديد رودوبسين النشط. يتم تشكيل الميتارودوبسين II خلال 1 مللي ثانية. يحدث تجديد الصباغ بعد اضمحلاله ببطء خلال عدة دقائق. وهذا يتطلب نقل الشبكية من المستقبلات الضوئية إلى الظهارة الصبغية.
هيكل رودوبسينعلى المستوى الجزيئي، يتكون بروتين الأوبسين من 348 بقايا من الأحماض الأمينية، مكونة 7 مناطق كارهة للماء، تتكون كل منها من 20-25 حمض أميني، مكونة 7 حلزونات عبر الغشاء. يقع الطرف N للجزيء في الفضاء خارج الخلية (أي داخل القرص القضيبي)، ويقع الطرف C في السيتوبلازم.
في الظلام، يرتبط 11-cis-retinal بإحكام ببروتين opsin. يؤدي التقاط الفوتون إلى إيزومرة جميع شبكية رابطة الدول المستقلة إلى شبكية ترون. في هذه الحالة، يتحول مجمع opsin-all-trons-retinal بسرعة إلى metarodo psin II، الذي ينفصل إلى opsin وall-trons retinal. يعتمد تجديد رودوبسين على تفاعل المستقبلات الضوئية والخلايا الظهارية الصبغية. يقوم Metarhodopsin II بتشغيل نظام المراسلة الثانوي والحفاظ عليه في حالة نشطة.
يرتبط الشبكية بالأوبسين من خلال بقايا اللايسين الموجودة في الجزء السابع من الغشاء. ينتمي Opsin إلى عائلة البروتينات التي تحتوي على 7 مجالات عبر الغشاء، والتي تتضمن أيضًا مستقبلات الناقلات العصبية الأيضية، مثل المستقبلات الأدرينالية والمسكارينية. مثل رودوبسين، تنقل هذه المستقبلات الإشارات إلى رسل ثانٍ من خلال تنشيط البروتين G. رودوبسين مستقر بشكل مدهش في الظلام. حسب بيور أن الأيزومرة الحرارية التلقائية لجزيء رودوبسين تتطلب حوالي 3000 سنة، أو 10 23 أكثر من الأيزومرية الضوئية.
أصباغ بصرية
أصباغ بصرية
هيكل رودوبسين
المخاريط ورؤية الألوان
عمى الألوان
الأدب
أصباغ بصرية
تتركز الأصباغ البصرية في أغشية الأجزاء الخارجية. يحتوي كل قضيب على حوالي 108 جزيئات صبغية. يتم تنظيمها في عدة مئات من الأقراص المنفصلة (حوالي 750 في قضيب القرد) غير المتصلة بالغشاء الخارجي. في المخاريط، يوجد الصباغ في طيات صبغية خاصة، وهي استمرار لغشاء الخلية الخارجي لمستقبل الضوء. تشكل جزيئات الصباغ حوالي 80٪ من جميع بروتينات القرص. تكون الأصباغ البصرية معبأة بكثافة في أغشية الجزء الخارجي بحيث لا تتجاوز المسافة بين جزيئين من الصباغ البصري في القضيب 10 نانومتر. تزيد هذه التعبئة الكثيفة من احتمالية التقاط فوتون من الضوء يمر عبر طبقة من الخلايا المستقبلة للضوء. وينشأ السؤال التالي: كيف تنشأ الإشارات عندما يمتص الضوء بواسطة الصبغات البصرية؟
امتصاص الضوء بواسطة الصبغات البصرية
تمت دراسة الأحداث التي تحدث عندما يمتص الضوء بواسطة صبغة القضيب، رودوبسين، باستخدام التقنيات الفسيولوجية النفسية والكيميائية الحيوية والجزيئية. يتكون جزيء الصباغ البصري من مكونين: بروتين يسمى أوبسين وكروموفور، وهو ألدهيد 11-سيس-فيتامين أ يسمى ريتينال (الشكل 1). يجب توضيح أن الكروموفور يحتوي على مجموعة كيميائية تعطي اللون للمركب. تمت دراسة الخصائص الكمية للقدرة الامتصاصية للأصباغ باستخدام القياس الطيفي. عندما تمت إضاءة رودوبسين، الصبغة البصرية للعصي، بضوء بأطوال موجية مختلفة، تم امتصاص الضوء الأزرق والأخضر بطول موجة يبلغ حوالي 500 نانومتر بشكل أفضل. تم الحصول على نتيجة مماثلة عندما تم إضاءة قضيب منفصل تحت المجهر بأشعة ضوئية ذات أطوال موجية مختلفة. تم التعرف على علاقة مثيرة للاهتمام بين طيف امتصاص الرودوبسين وإدراكنا لضوء الشفق. أظهرت الدراسات الفيزيائية النفسية الكمية التي أجريت على البشر أن ضوء النهار الأخضر المزرق بطول موجة يبلغ حوالي 500 نانومتر هو الأمثل لإدراك ضوء الشفق في الظلام. خلال النهار، عندما تكون العصي غير نشطة ويتم استخدام المخاريط فقط، نكون أكثر حساسية للون الأحمر الذي يتوافق مع طيف امتصاص المخاريط (سنتحدث عن هذا لاحقًا).
عندما يمتص رودوبسين فوتونًا واحدًا، تخضع شبكية العين لعملية الأيزومرية الضوئية وتنتقل من التكوين 11-cis إلى التكوين العابر. يحدث هذا الانتقال بسرعة كبيرة: في حوالي 10-12 ثانية. بعد ذلك، يخضع الجزء البروتيني من الصبغة أيضًا لسلسلة من تغييرات التحول، مع تكوين عدد من المنتجات الوسيطة. أحد أشكال جزء البروتين، الميتارودوبسين II، هو الأكثر أهمية لنقل الإشارة (سنناقش هذا لاحقًا في هذا الفصل). ويبين الشكل 2 تسلسل الأحداث أثناء التبييض وتجديد رودوبسين النشط. يتم تشكيل الميتارودوبسين II خلال 1 مللي ثانية. يحدث تجديد الصباغ بعد اضمحلاله ببطء خلال عدة دقائق. وهذا يتطلب نقل الشبكية من المستقبلات الضوئية إلى الظهارة الصبغية.
هيكل رودوبسين
على المستوى الجزيئي، يتكون بروتين الأوبسين من 348 بقايا من الأحماض الأمينية، مكونة 7 مناطق كارهة للماء، تتكون كل منها من 20-25 حمض أميني، مكونة 7 حلزونات عبر الغشاء. يقع الطرف N للجزيء في الفضاء خارج الخلية (أي داخل القرص القضيبي)، ويقع الطرف C في السيتوبلازم.
رسم بياني 1. هيكل رودوبسين الفقاريات المضمن في غشاء مستقبلات الضوء. يتم تدوير الحلزون قليلاً لإظهار موقع الشبكية (المشار إليه باللون الأسود). C - نهاية C، N - نهاية N.
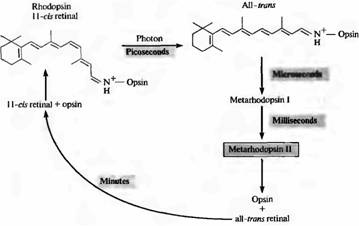
الصورة 2. تلاشي الرودوبسين في الضوء. في الظلام، يرتبط 11-cis-retinal بإحكام ببروتين opsin. يؤدي التقاط الفوتون إلى إيزومرة جميع شبكية رابطة الدول المستقلة إلى شبكية ترون. في هذه الحالة، يتحول مجمع opsin-all-trons-retinal بسرعة إلى metarodo psin II، الذي ينفصل إلى opsin وall-trons retinal. يعتمد تجديد رودوبسين على تفاعل المستقبلات الضوئية وخلايا الظهارة الصبغية. يقوم Metarhodopsin II بتشغيل نظام المراسلة الثانوي والحفاظ عليه في حالة نشطة.
يرتبط الشبكية بالأوبسين من خلال بقايا اللايسين الموجودة في الجزء السابع من الغشاء. ينتمي Opsin إلى عائلة البروتينات التي تحتوي على 7 مجالات عبر الغشاء، والتي تتضمن أيضًا مستقبلات الناقلات العصبية الأيضية، مثل المستقبلات الأدرينالية والمسكارينية. مثل رودوبسين، تنقل هذه المستقبلات الإشارات إلى رسل ثانٍ من خلال تنشيط البروتين G. رودوبسين مستقر بشكل مدهش في الظلام. حسب بيور أن الأيزومرة الحرارية التلقائية لجزيء رودوبسين تتطلب حوالي 3000 سنة، أو 10 23 أكثر من الأيزومرية الضوئية.
المخاريط ورؤية الألوان
لقد لفتت الأبحاث والتجارب المذهلة التي أجراها يونج وهيلمهولتز في القرن التاسع عشر الانتباه إلى حد كبير امر هامحول رؤية الألوان، وقد قدم العلماء أنفسهم تفسيراً واضحاً ودقيقاً لهذه الظاهرة. استنتاجهم حول وجود ثلاثة أنواع مختلفةلقد صمدت المستقبلات الضوئية الملونة أمام اختبار الزمن وتم تأكيدها لاحقًا على المستوى الجزيئي. مرة أخرى، يمكننا أن نقتبس من هيلمهولتز، الذي قارن بين إدراك الضوء والصوت واللون ونغمة الصوت. ويمكن للمرء أن يحسده على وضوح فكره وقوته وجماله، خاصة بالمقارنة مع المفاهيم الحيوية المربكة التي كانت منتشرة في القرن التاسع عشر:
كل الاختلافات في درجات الألوان تعتمد على الجمع بنسب مختلفة بين الألوان الأساسية الثلاثة.. الأحمر والأخضر والبنفسجي.. كما أن إدراك ضوء الشمس ودفئه يعتمد.. على مدى وصول أشعة الشمس إلى الأرض الأعصاب، قادمة من مستقبلات الرؤية أو من مستقبلات الحساسية الحرارية. وكما اقترح يونج في فرضيته، فإن الاختلاف في إدراك الألوان المختلفة يعتمد ببساطة على أي من الأنواع الثلاثة من المستقبلات الضوئية يتم تنشيطه أكثر بواسطة هذا الضوء. عندما تكون جميع الأنواع الثلاثة موجودة على قدم المساواةمتحمس ، اتضح الأبيض ...
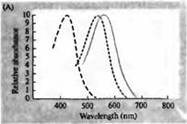
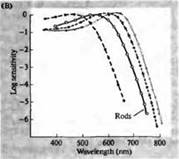
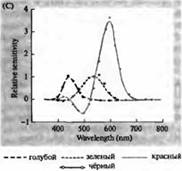
أرز. 3. حساسية أطياف المستقبلات الضوئية للإنسان ومختلفها أصباغ بصرية. (أ) منحنيات أطياف الحساسية لثلاثة أصباغ بصرية ملونة، تظهر قمم الامتصاص عند الأطوال الموجية المقابلة للأزرق والأخضر والأحمر. (ب) أطياف حساسية المخاريط للأزرق والأخضر والأحمر، والقضبان (كما هو موضح باللون الأسود) في قرود المكاك. تم تسجيل الاستجابات باستخدام أقطاب الشفط، ومتوسطها، وتطبيعها. تم الحصول على منحنيات الطيف القضيبي من دراسات الأصباغ البصرية لدى البشر. (ج) مقارنة أطياف القرد والمخروط البشري باستخدام اختبار حساسية اللون. يُظهر المنحنى المستمر تجربة لتحديد حساسية اللون لدى البشر من خلال تعريضهم لضوء ذو أطوال موجية مختلفة. يوضح الخط المنقط النتائج المتوقعة من تسجيل التيارات في المخاريط الفردية، بعد تصحيح امتصاص الضوء في العدسة والأصباغ في الطريق إلى الجزء الخارجي. الاتفاق بين نتائج كلتا التجربتين مرتفع بشكل مدهش.
إذا قمنا بإسقاط شعاعين من الضوء بألوان مختلفة في وقت واحد على شاشة بيضاء... فإننا نرى لونًا واحدًا فقط، يختلف إلى حد ما عن هذين اللونين. يمكننا أن نفهم بشكل أفضل الحقيقة الرائعة المتمثلة في أننا قادرون على إدراك جميع الظلال في تركيبة الضوء الخارجي من خلال مزيج من الألوان الأساسية الثلاثة، إذا قارنا العين الجافة... وفي حالة الصوت... نسمع الموجات الأطول مثل النغمات المنخفضة، والموجات الأقصر - مثل النغمات العالية والخارقة، بالإضافة إلى أن الأذن قادرة على التقاط العديد من الموجات الصوتية في نفس الوقت، أي. الكثير من الملاحظات. ومع ذلك، في هذه الحالة لا تندمج في وتر واحد معقد، تمامًا كما تندمج الألوان المختلفة في لون واحد معقد. العين لا تستطيع أن تفرق إذا استبدلنا لون برتقاليإلى الأحمر أو الأصفر. لكن إذا سمعنا النغمتين C وE تنطقان في وقت واحد، فإن مثل هذا الصوت لا يبدو لنا أنه نغمة D. إذا أدركت الأذن النغمات الموسيقية بنفس الطريقة التي تدرك بها العين الألوان، فيمكن تمثيل كل وتر بمزيج من ثلاث نغمات ثابتة، واحدة منخفضة جدًا، وواحدة عالية جدًا، وواحدة بينهما، مما يسبب جميع التأثيرات الموسيقية المحتملة فقط عن طريق التغييرات في الجهارة النسبية لهذه النغمات الثلاث... إلا أننا قادرون على رؤية انتقال سلس للألوان من لون إلى آخر عبر عدد لا نهائي من الظلال والتدرجات... تعتمد الطريقة التي ندرك بها كل لون... بشكل أساسي على هيكل لدينا الجهاز العصبي. يجب الاعتراف بأنه في الوقت الحاضر لم يتم وصف الأساس التشريحي لتأكيد نظرية إدراك اللون لدى البشر أو ذوات الأربع.
تم تأكيد هذه التنبؤات الدقيقة وبعيدة النظر من خلال سلسلة من الملاحظات المختلفة. وباستخدام القياس الطيفي، أظهر والد وبراوك وماكنيكول ودارتنال وزملاؤهم وجود ثلاثة أنواع من المخاريط ذات أصباغ مختلفة في شبكية العين البشرية. كما تمكن بايلور وزملاؤه من تحويل التيارات عن مخاريط القرود والبشر. تم العثور على المجموعات المخروطية الثلاثة لديها نطاقات متميزة ولكن متداخلة من الحساسية للأجزاء الأزرق والأخضر والأحمر من الطيف. تزامنت الأطوال الموجية المثالية للإشارات الكهربائية المثيرة تمامًا مع قمم امتصاص الضوء بواسطة الأصباغ البصرية، والتي تم تحديدها باستخدام قياس الطيف الضوئي والتجارب النفسية الفيزيائية لقياس حساسية العين لطيف الألوان. وفي نهاية المطاف، قام ناتيس باستنساخ وتسلسل الجينات التي تشفر صبغة الأوبسين في ثلاثة أنواع من المخاريط الحساسة للطيف الأحمر والأخضر والأزرق.
كيف تكون جزيئات الأصباغ البصرية المختلفة قادرة على التقاط ضوء بطول موجي معين بشكل تفضيلي؟ اتضح أن رودوبسين هو الصبغة البصرية للعصي وجميع الصبغات البصرية الثلاثة للمخاريط تحتوي على نفس الكروموفور، 11-cis-retinal. ومع ذلك، فإن تسلسل الأحماض الأمينية للجزء البروتيني من الصباغ يختلف عن بعضها البعض. تفسر الاختلافات في عدد قليل من الأحماض الأمينية حساسيتها المختلفة للطيف.
عمى الألوان
على الرغم من أن أحد أنواع المستقبلات الضوئية غير قادر على إدراك اللون من تلقاء نفسه، إلا أن الأنواع الثلاثة من المخاريط، كما هو موضح في الشكل. 4 قادرون بالفعل.
من حيث المبدأ، سيكون هناك نوعان من المخاريط ذات أصباغ مختلفة كافية للتعرف على الألوان، ولكن في هذه الحالة سيتم إدراك عدد من مجموعات الأطوال الموجية بشكل متساوٍ. وينشأ موقف مماثل عندما يعاني الشخص من عمى الألوان. وهؤلاء الأشخاص، كما أظهر ناثانز، لديهم عيوب وراثية تؤدي إلى غياب أحد الصبغات. ومن أعلى مستويات الوضع العلمي الحالي، لا يسعنا إلا أن نندهش من مدى جمال الآليات الجزيئية التي تؤكد التفكير الرائع والدقيق بشكل مدهش ليونج وهيلمهولتز.
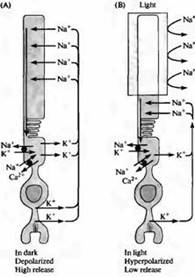
أرز. 4. التيار "المظلم" في القضيب. (أ) في الظلام، تمر أيونات الصوديوم عبر القنوات الموجبة في الجزء الخارجي من القضبان، مما يسبب إزالة الاستقطاب؛ أيونات الكالسيوم قادرة أيضًا على المرور عبر قنوات الكاتيون هذه. تمر الحلقة الحالية عبر برزخ القضيب نظرًا لحقيقة أن تيار البوتاسيوم يتدفق في اتجاه خارجي في الجزء الداخلي من الغشاء. (ب) عند حدوث إضاءة الجزء الخارجي، تغلق القنوات بسبب انخفاض تركيز cGMP داخل الخلايا، ويفرط الاستقطاب في القضيب. فرط الاستقطاب يؤدي إلى انخفاض في إطلاق المرسل. يتم الحفاظ على تركيزات الصوديوم والبوتاسيوم والكالسيوم داخل القضيب بواسطة مضخات خاصة ومبادلات أيونية موجودة في منطقة الجزء الداخلي (الدوائر السوداء). توجد ناقلات الكالسيوم أيضًا في الجزء الخارجي.
تم تأكيد فكرتهم القائلة بأن السمات الأساسية لرؤية الألوان وعمى الألوان يجب العثور عليها في المستقبلات الضوئية نفسها باستخدام قياسات فسيولوجية مباشرة، وكذلك من خلال دراسة الاختلافات في بنية الأصباغ على المستوى الجيني والبروتيني، فإن الإمكانات موجودة. من -40 مللي فولت ، وهو بعيد عن جهد البوتاسيوم المتوازن E K ، وهو 80 مللي فولت.

أرز. 5. دور الـ cGMP في فتح قنوات الصوديوم في الجزء الخارجي للقضبان. تم تسجيل نشاط القنوات المفردة باستخدام مشبك التصحيح من الداخل إلى الخارج الموجود في محلول بتركيزات مختلفة من cGMP. يؤدي فتح القناة إلى انحراف التيار إلى الأعلى. كان تردد فتح القناة منخفضًا جدًا في مجموعة التحكم؛ أدت إضافة cGMP إلى زيادة تردد فتح القناة الواحدة، والذي كان يعتمد بشكل مباشر على تركيز cGMP
يتم نقل التيار الوارد في الظلام في المقام الأول عن طريق أيونات الصوديوم التي تتبع التدرج الكهروكيميائي من خلال قنوات الكاتيون في الجزء الخارجي. يحدث فرط الاستقطاب للمستقبل الضوئي تحت تأثير الضوء بسبب إغلاق هذه القنوات، مما يؤدي إلى تحول في جهد الغشاء نحو E K.
خصائص القنوات المستقبلة للضوء
تحتوي قنوات الكاتيون في الجزء الخارجي في ظل الظروف الفسيولوجية على نسبة توصيل أيونات الكالسيوم/الصوديوم/البوتاسيوم تبلغ 12.5:1.0:0.7 وموصلية قناة واحدة تبلغ حوالي 0.1 pS 21). ولأن تركيز الصوديوم أعلى بكثير من تركيز الكالسيوم، فإن حوالي 85% من التيار الوارد يأتي من أيونات الصوديوم. يتم توجيه القوة الدافعة لأيونات البوتاسيوم إلى خارج الخلية. عندما تمر أيونات الكالسيوم عبر القناة، ترتبط هذه الأيونات بقوة بجدار المسام وبالتالي تتداخل مع مرور الأيونات الأخرى. ولهذا السبب، فإن إزالة الكالسيوم من البيئة خارج الخلية تؤدي إلى سهولة مرور أيونات البوتاسيوم والصوديوم عبر القنوات، والتي تزيد موصليتها إلى 25 pS.
أظهر فيسينكو وياو وبايلور وستراير وزملاؤه أن GMP الدوري يلعب دور حامل الإشارة الداخلية من القرص إلى سطح الغشاء. كما هو مبين في الشكل 4، فإن التركيز العالي لـ cGMP في السيتوبلازم يبقي قنوات الكاتيون مفتوحة. مع انخفاض تركيز cGMP من السطح الداخلي للغشاء، يصبح فتح قنوات الكاتيون حدثًا نادرًا. وبالتالي، فإن إمكانات الغشاء للمستقبلات الضوئية هي انعكاس لتركيز cGMP في السيتوبلازم: كلما زاد تركيز cGMP، زاد استقطاب الخلية. ويعتمد تركيز cGMP بدوره على شدة الضوء الساقط. تؤدي زيادة شدة الضوء إلى انخفاض تركيز cGMP وتقليل نسبة القنوات المفتوحة. في غياب cGMP، يتم إغلاق جميع القنوات تقريبًا، وتقترب مقاومة غشاء الجزء الخارجي من مقاومة الطبقة الدهنية الثنائية.
التركيب الجزيئي للقنوات ذات البوابات cGMP
تم عزل [كدنا] للقنوات الأيونية للجزء الخارجي من القضبان وتم تحديد تسلسل الأحماض الأمينية للوحدات الفرعية لهذه القنوات في شبكية العين لدى البشر والأبقار والفئران والدجاج. تم العثور على تشابه كبير في الحمض النووي لهذه القنوات وغيرها من القنوات الأيونية ذات البوابات cGMP - مثل تلك الموجودة في الجهاز الشمي
نقل الإشارة في المستقبلات الضوئية
كيف تؤدي الأيزومرية الضوئية للرودوبسين إلى تغيرات في إمكانات الغشاء؟ لسنوات عديدة كان من المفهوم أن هناك حاجة إلى نوع ما من الرسائل الداخلية لإثارة الإشارات الكهربائية في القضبان والأقماع. أحد أسباب الشك في أن المعلومات المتعلقة بامتصاص الفوتونات في منطقة الجزء الخارجي من القضيب يتم نقلها باستخدام حامل هو حقيقة أن صبغة رودوبسين نفسها موجودة داخل القرص، وتنتشر الإشارة عبر السيتوبلازم إلى الغشاء الخارجي. أما السبب الثاني فهو الزيادة الكبيرة في الاستجابة. أظهر بايلور وزملاؤه، الذين يدرسون المستقبلات الضوئية للسلاحف، أن الانخفاض في موصلية الغشاء والإشارات الكهربائية المسجلة يحدث حتى مع امتصاص فوتون واحد فقط وتنشيط واحد من 10 8 جزيئات صبغية.
تم توضيح تسلسل الأحداث التي يغير فيها جزيء الصباغ الضوئي المنشط إمكانات الغشاء من خلال دراسة الأجزاء الخارجية من القضبان والمخاريط باستخدام تقنيات التثبيت المحتملة ثنائية القطب والبيولوجيا الجزيئية. يظهر الشكل 1 مخطط نقل الإشارة من امتصاص فوتون الضوء إلى الإشارة الكهربائية. 3.
في الظلام، يتدفق تيار "مظلم" وارد ثابت في الأجزاء الخارجية من القضبان والأقماع. نتيجة لنظامهم الغشائي. تُظهر المناطق الغشائية لهذه القنوات أوجه تشابه هيكلية مع القنوات الانتقائية الكاتيونية الأخرى، خاصة في منطقة S4 وفي المنطقة التي تشكل المسام الأيونية. القنوات الأيونية المستقبلة للضوء عبارة عن رباعيات تتكون من وحدتين فرعيتين مختلفتين من البروتين على الأقل مع كتل جزيئية تبلغ 63 و 240 كيلو دالتون على التوالي.
تقع مواقع ربط النوكليوتيدات داخل الخلايا بالقرب من نهاية الكربوكسيل للوحدات الفرعية. يؤدي التعبير عن هذه الوحدات الفرعية في البويضات إلى تكوين قنوات كاتيونية لها خصائص مشابهة لتلك الموجودة في الأجزاء الخارجية من القضبان: يتم تنشيطها بواسطة cGMP ولها نسب التوصيل والنفاذية المتوقعة.

أرز. 6. آلية تنشيط البروتين G أثناء تنشيط جزيء الصبغ الضوئي. يربط بروتين G-transducin GTP في وجود الميتارودوبسين II، مما يؤدي إلى تنشيط إنزيم فوسفودايستراز، والذي بدوره يتحلل cGMP. ومع انخفاض تركيز cGMP، تغلق قنوات الصوديوم.
سلسلة الأيض GMP الدورية
يظهر الشكل 5 سلسلة الأحداث التي تؤدي إلى انخفاض تركيز cGMP والإغلاق اللاحق للقنوات الأيونية. يحدث الانخفاض في تركيز cGMP داخل الخلايا بسبب الضوء، مما يؤدي إلى تكوين ميتارودوبسين II، وهو وسيط في انهيار الأصباغ الضوئية. يعمل الميثارودوبسين II بدوره على بروتين G-transducin، الذي يتكون من 3 سلاسل متعددة الببتيد
يؤدي تفاعل الميتارودوبسين II والترنسدوسين إلى استبدال الناتج المحلي الإجمالي للجزيء المرتبط بالبروتين G بـ GTP. يؤدي هذا إلى تنشيط الوحدة الفرعية للبروتين G، التي تنفصل عن الوحدات الفرعية، وتقوم بدورها بتنشيط إنزيم الفوسفوديستراز الموجود في منطقة الغشاء: وهو الإنزيم الذي يتحلل cGMP. ينخفض تركيز cGMP، ويقل عدد القنوات الأيونية المفتوحة، ويزداد استقطاب القضيب. تتم مقاطعة الشلال عن طريق فسفرة الطرف C من ميتارودوبسين II النشط. تم تأكيد الدور الرئيسي لـ cGMP في تنظيم حالة قنوات الكاتيون من خلال التجارب البيوكيميائية. يمكن أن تؤدي إضاءة المستقبلات الضوئية إلى انخفاض بنسبة 20% في مستويات cGMP في الخلية.
المستقبلات الفقارية التي تزيل الاستقطاب عند تعرضها للضوء
الاستثناء المثير للاهتمام لآلية الاستقبال الضوئي المذكورة أعلاه هو بعض المستقبلات في الفقاريات. السحالي لديها عين ثالثة تقع في الجزء العلوي من رؤوسهم. يحتوي على "مخاريط" صغيرة قادرة على إدراك صورة مشابهة لتلك التي تراها العيون الرئيسية (الجانبية). ومع ذلك، تتميز هذه المستقبلات الضوئية بأنها تزيل الاستقطاب عند إضاءتها. تتمتع القنوات المرتبطة بالنيوكليوتيدات هنا ببنية ووظيفة مشابهة للمستقبلات الضوئية لدى الفقاريات الأخرى، مع استثناء واحد: تنشيط المستقبل الضوئي والبروتين G يؤدي إلى زيادة في تركيز cGMP. ونتيجة لذلك، تنفتح قنوات الجزء الخارجي ويتم توجيه الكاتيونات إلى داخل الخلية، لتشكل تيارًا "خفيفًا". يحدث هذا بسبب تثبيط نشاط إنزيم الفوسفوديستراز في الظلام. ونتيجة لذلك، يحدث التسلسل التالي للأحداث في عين السحلية: الضوء - [cGMP] - فتح القنوات الموجبة للجزء الخارجي - إزالة الاستقطاب.
تضخيم الإشارة في سلسلة cGMP
توفر سلسلة cGMP ذات المرحلتين زيادة كبيرة في الإشارة الأولية، وهو ما يفسر الحساسية الاستثنائية للقضبان للضوء. أولاً، يحفز جزيء واحد من الميتارودوبسين II النشط إضافة العديد من جزيئات GTP بدلاً من الناتج المحلي الإجمالي، وبالتالي يطلق مئات من الوحدات الفرعية للبروتين G. ثانيًا، تقوم كل وحدة فرعية بتنشيط جزيء فوسفودايستراز واحد في القرص، وهو قادر على تحطيم العدد الهائل من جزيئات cGMP الموجودة في السيتوبلازم وبالتالي يؤدي إلى إغلاق عدد كبير من القنوات.
إشارات استجابة لكمية واحدة من الضوء
لقد تم تقديم أدلة على أن الكميات الفردية للضوء يمكن أن تنتج الإحساس المدرك بالضوء عدد كبير منأسئلة. ما حجم هذا الرد الفردي؟ كيف يتم فصل هذه الإشارة عن مستوى الضوضاء؟ وكيف يتم نقل هذه المعلومات بشكل موثوق من شبكية العين إلى المراكز البصرية العليا؟ ولقياس الإشارات استجابةً لكمات ضوئية منفردة، سجل بايلور وزملاؤه تيارات من العصي الفردية في شبكية عيون الضفادع والقردة والبشر. تمثل هذه التجارب مثالاً فريدًا للتجربة التي توضح كيفية ذلك عملية صعبة، مثل إدراك ومضات الضوء الخافتة، قد يرتبط بالتغيرات التي تحدث على مستوى الجزيئات الفردية.
يجب أن يتم إجراء عزل جزء من الشبكية من مادة حيوانية أو جثثية في الظلام لإجراء هذه التجارب. لقياس التيار، يتم امتصاص الجزء الخارجي من القضيب في ماصة رفيعة. وكما هو متوقع، تظهر هذه التجارب أنه في الظلام، يتدفق التيار باستمرار إلى الجزء الخارجي. وتؤدي ومضات الضوء إلى إغلاق القنوات في الجزء الخارجي، مما يتسبب في انخفاض التيار "المظلم". السعة الحالية صغيرة وتتناسب مع عدد الكمات الممتصة. أحيانًا يصدر الفلاش استجابة واحدة، وأحيانًا استجابة مزدوجة، وأحيانًا لا يصدر أي استجابة على الإطلاق.
في العصيات القردية، يكون الانخفاض في التيار استجابة لامتصاص فوتون واحد حوالي 0.5 باسكال. ويقابل ذلك إغلاق نحو 300 قناة، أي. من 3 إلى 5% من جميع القنوات مفتوحة في الظلام. يتم تحقيق ذلك بسبب الزيادة الكبيرة في الإشارة في عملية التمثيل الغذائي سلسلة cGMP. علاوة على ذلك، نظرًا للاستقرار الشديد للأصباغ البصرية المذكورة سابقًا، فإن الأيزومرية العشوائية والإغلاق الكاذب للقناة يعدان من الأحداث النادرة جدًا. يؤدي هذا إلى ظهور تأثيرات الكمات الضوئية الفردية على خلفية ضوضاء ثابتة منخفضة جدًا. تبين أن الاقتران الكهربائي من خلال تقاطعات الفجوة بين المستقبلات الضوئية يوفر تأثيرًا إضافيًا للتنعيم يقلل من ضوضاء الخلفية ويحسن نسبة الإشارة إلى الضوضاء لاستجابات القضبان للكميات الفردية.
الأدب
1. فين، جيه تي، جرونوالد، إم إي، وياو، كيه دبليو. 1996. القنوات الأيونية ذات النوكليوتيدات الحلقية: عائلة ممتدة ذات وظائف متنوعة. آنو. القس. فيزيول.58: 395-426.
2. Nakanishi, S., Nakajima, Y., Masu, M., Ueda, Y., Nakahara, K., Watanabe, D., Yamaguchi, S., Kawabata, S., and Okada, M. 1998. الغلوتامات المستقبلات: وظيفة الدماغ ونقل الإشارة.
الأصباغ المرئية(طلاء الصباغ اللاتيني) - أصباغ حساسة للضوء لمستقبلات الشبكية الضوئية. عند إدراك طاقة النبضة الضوئية، تخضع العناصر لدورة كيميائية ضوئية معقدة. التحولات، ونتيجة لذلك يدخل مستقبل بصري منفصل للشبكية، يحتوي على 3. ص (مخروط أو قضيب)، في حالة متحمس وينقل المعلومات المستلمة إلى الجهاز العصبي المركزي على طول العصب البصري. ن. مع. كونها الجزء الهيكلي والوظيفي الرئيسي للغشاء المستقبل للضوء للخلايا البصرية لشبكية العين، 3. ص وبالتالي تلعب دورا رئيسيافي آليات الرؤية (انظر).
التسميات وهيكل الأصباغ البصرية. جميع الحيوانات الفقارية واللافقارية التي تمت دراستها عبارة عن مجمعات من بروتين الغشاء غير القابل للذوبان في الماء أوبسين والكروموفور المرتبط به (الشبكي). يمكن أن يوجد الشبكية، أو ألدهيد فيتامين أ، في شكلين - الشبكية 1 والشبكية 2.
وفقًا لطبيعة الكروموفور، 3. ص تنقسم إلى فئتين - رودوبسين (انظر) تحتوي على الشبكية 1، والبورفيروبسينات التي تحتوي على الشبكية 2. الرودوبسين موجود في شبكية عيون جميع الحيوانات البرية والبحرية، والبورفيروبسين موجود في شبكية عيون حيوانات المياه العذبة. وفي بعض الأسماك والبرمائيات، تم العثور على 3. مادة تحتوي على شبكية العين في وقت واحد! والشبكية. هناك محاولات لتصنيف 3.p على أساس الاختلافات في الأوبسينات الخاصة بالعصي أو المخاريط في شبكية العين. على سبيل المثال، رودوبسين عبارة عن مركب من الشبكية 1 مع أوبسين قضيبي، ويودوبسين عبارة عن مركب من الشبكية 1 مع أوبسين مخروطي، والبورفيروبسين عبارة عن مركب من الشبكية 2 مع أوبسين قضيبي، ويشكل مجمع أوبسين مخروطي شبكي سيانوبسين. ومع ذلك، من الصعب للغاية تصنيف 3.p على أساس الأوبسينات، نظرًا لوجود خمسة أوبسينات مختلفة على الأقل.
من بين جميع الأنواع الثلاثة المعروفة، تمت دراسة الرودوبسينات المعزولة من عيون الثيران والضفادع والحبار بشكل كامل. يقولون الوزن (الكتلة) حوالي 30-40 ألف، كل جزيء يحتوي تقريبا. 400 حمض أميني وكروموفور واحد. بالإضافة إلى ذلك، يتضمن الجزيء 3.p سلسلة قليلة السكاريد: 3 جذور الجلوكوزامين، 2 مانوز، 1 جلاكتوز. تشكل الدهون (الدهون الفوسفاتية بشكل رئيسي) مركبًا قويًا مع جزيء 3.p. مع احتفاظها بخصائصها الطيفية الأساسية (انظر التحليل الطيفي)، تفقد 3.p بدون الدهون عددًا من الخصائص المهمة وظيفيًا، على سبيل المثال، القدرة على التعافي.
الشبكية النقية لديها أصفر، الحد الأقصى لطيف الامتصاص يقع في منطقة 370 نانومتر. الأوبسين عديم اللون، أقصى امتصاص له يقع في منطقة الأشعة فوق البنفسجية (حوالي 280 نانومتر). لون جزيء رودوبسين هو وردي محمر، والحد الأقصى لطيف الامتصاص هو تقريبا. 500 نانومتر. سبب هذا التحول الطيفي القوي أثناء تكوين المجمع (من 370 إلى 500 نانومتر - ما يسمى بالتحول الباثوكرومي) لم يتلق بعد تفسيرًا لا لبس فيه.
يغطي الحد الأقصى لأطياف الامتصاص للرودوبسين والبورفيروبسين منطقة واسعة إلى حد ما من الطيف المرئي - من 433 إلى 562 نانومتر للرودوبسين ومن 510 إلى 543 نانومتر للبورفيروبسين. إذا كانت المخاريط الثالثة من الشرغوف من الضفدع والكارب وسلحفاة المياه العذبة تعتبر أيضًا بورفيروبسين، أي السيانوبسين مع أقصى طيف امتصاص عند 620 نانومتر، فإن هذه المنطقة أكثر اتساعًا. لقد أتاح تطوير طرق قياس الطيف الضوئي المجهري تحديد أطياف الامتصاص لأنواع عديدة من الخلايا المستقبلة للضوء الفردية في الحيوانات والبشر. وفقا للبيانات التي تم الحصول عليها، 3.p. من شبكية العين البشرية لها أطياف الامتصاص القصوى التالية: العصي 498، المخاريط الحساسة للأزرق والأخضر والأحمر - 440، 535 و 575 نانومتر، على التوالي.
دراسة 3. ص بدأت باللغة الألمانية. مولر، الذي وصف في عام 1851 كيف تصبح شبكية العين ذات اللون الأرجواني الوردي، المستخرجة من عين الضفدع، صفراء ثم بيضاء في الضوء. في عام 1877، وصف F. Boll أيضًا هذه الظاهرة، وخلص إلى أنه يوجد في الخلايا البصرية لشبكية العين نوع من المادة الحساسة للضوء الأحمر وأن تغير لون هذه المادة يرتبط بآلية الرؤية. يرجع الفضل الأكبر في دراسة النقاط الثالثة إلى كوهني (W. Kuhne, 1877)، الذي تمكن من عزل النقاط الثالثة ودراستها بالتفصيل. قام بتسمية 3.p. واستخرج اللون الأرجواني البصري، وحدد طبيعته البروتينية، وبحث في بعض خصائصه الطيفية وتحولاته الضوئية، واكتشف قدرة 3.p على الاستعادة في الظلام. عامر قدم مساهمة كبيرة في دراسة 3. ص. عالم الكيمياء الحيوية وعالم وظائف الأعضاء ج.والد.
التحولات الضوئية للأصباغ البصرية. عند تعرض 3.p للضوء، تحدث دورة كيميائية ضوئية فيها. التحولات، التي تعتمد على التفاعل الكيميائي الضوئي الأولي لأيزومرية cis-trans للشبكية (انظر الأيزومرية). في هذه الحالة، يتم تعطيل الاتصال بين الكروموفور والبروتين. يمكن تقديم تسلسل تحولات 3.p على النحو التالي: رودوبسين (الكروموفور في شكل رابطة الدول المستقلة) -> بريلوميرودوبسين -> لوميرهودوبسين -> ميتارودوبسين I -> ميتارودوبسين II -> بروتين أوبسين -> كروموفور في شكل متحول. تحت تأثير الإنزيم - الريتينول ديهيدروجينيز - يتحول الأخير إلى فيتامين أ، الذي يأتي من الأجزاء الخارجية للقضبان والأقماع إلى خلايا الطبقة الصبغية لشبكية العين. عندما تغمق العين، يحدث تجديد 3.p.لتنفيذ القطع، من الضروري وجود أيزومر cis لفيتامين A، والذي يعمل كمنتج أولي لتكوين الكروموفور (فيتامين أ ألدهيد). إذا كان هناك نقص أو غياب فيتامين (أ) في الجسم، فقد يتعطل تكوين رودوبسين، ونتيجة لذلك، قد يتطور اضطراب الرؤية الشفقية، ما يسمى. العمى الليلي (انظر Hemeralopia). في عملية التحول الضوئي للرودوبسين في مرحلة انتقال اللوميرهودوبسين إلى الميتارودوبسين الأول في الخلية المستقبلة يحدث استجابة للوميض الساطع لما يسمى. إمكانات المستقبلات المبكرة (كمون قصير). ومع ذلك، فهو ليس كذلك إشارة بصريةعلى الرغم من أنه يمكن أن يكون بمثابة أحد الاختبارات لدراسة آلية تحولات 3. ص في الغشاء المستقبل للضوء. الأهمية الوظيفية هي ما يسمى. إمكانات المستقبل المتأخرة، الفترة الكامنة منها (5-10 مللي ثانية) قابلة للمقارنة مع وقت تكوين الميتارودوبسين II. من المفترض أن رد فعل انتقال الميتارودوبسين الأول إلى الميتارودوبسين الثاني يوفر ظهور الإشارة المرئية.
وبما أن 3. ص يتغير لونها بشكل مستمر في الضوء، فلا بد من وجود آليات لترميمها المستمر. بعضها سريع للغاية (التجديد الضوئي)، والبعض الآخر سريع جدًا (الكيمياء الحيوية، التجديد، الظلام)، والبعض الآخر بطيء (توليف 3. ص. أثناء التجديد المستمر للغشاء المستقبل للضوء في الخلية البصرية). التجديد الضوئي هو فيزيول، وهو مهم في الحيوانات اللافقارية (على سبيل المثال، رأسيات الأرجل- الأخطبوط والحبار). في آلية الكيمياء الحيوية في تجديد 3.p. في الفقاريات، يبدو أن دورًا مهمًا يلعبه إنزيم الأيزوميراز (انظر)، والذي يضمن تصاوغ الشبكية (أو الفيتامين A) مرة أخرى إلى شكل cis-isomeric. ومع ذلك، لا يتوفر بعد دليل قاطع على وجود مثل هذا الإنزيم. إن تفاعل تكوين جزيء 3.p في وجود أيزومر 11-cis للشبكية والأوبسين يحدث بسهولة، دون استهلاك الطاقة. تم اكتشاف قدرة الرودوبسين المبيض على الخضوع لتفاعل الفسفرة (انظر)؛ ومن المفترض أن يكون رد الفعل هذا أحد الروابط في آلية تكيف الخلية البصرية مع الضوء.
فهرس:أكرمان يو الفيزياء الحيوية، عبر. من الإنجليزية، م.، 1964؛ ويلي ك. وديت إي في. علم الأحياء، عبر. من الإنجليزية، م.، 1974، ببليوجر. Konev S. V. و Volotovsky I. D. مقدمة في علم الأحياء الضوئية الجزيئية، ص. 61، مينسك، 1971؛ Ostrovsky M. A. و Fedorovich I. B. التغييرات التي تحدثها الصور في غشاء مستقبلات الضوء، في الكتاب: هيكل ووظائف البيول، الأغشية، إد. إيه إس تروشينا وآخرون، ص. 224، م، 1975، ببليوجر. فسيولوجيا النظم الحسية، أد. جي في غيرشوني، الجزء الأول، ص. 88، ل.، 1971؛ الكيمياء الحيوية وعلم وظائف الأعضاء من الأصباغ البصرية، أد. بواسطة H. لانجر، V. أ. س، 1973؛ دليل علم وظائف الأعضاء الحسية، أد. بواسطة H. A. R. جونغ أ. س.، ضد. 7، الصفحات 1-2، ب، 1972.
ماجستير أوستروفسكي.



