أصباغ بصرية. استقبال ضوئي. أي من قذائف مقلة العين شفافة في المقدمة. الجسم الركبي الجانبي هو هيكل
أصباغ مرئية(lat. pigmentum paint) - أصباغ حساسة لمستقبلات الشبكية الضوئية. 3. بإدراك طاقة نبضة الضوء ، تخضع العناصر لدورة كيميائية ضوئية معقدة. التحولات ، ونتيجة لذلك ينتقل مستقبل بصري منفصل لشبكية العين ، يحتوي على 3. ص (مخروط أو قضيب) ، إلى حالة الإثارة وينقل المعلومات المستلمة على طول العصب البصري إلى ج. ن. مع. كونه الجزء الهيكلي والوظيفي الرئيسي لغشاء المستقبل الضوئي للخلايا البصرية لشبكية العين ، 3. ص. دورا رئيسيافي آليات الرؤية (انظر).
التسمية والهيكل أصباغ بصرية. تمت دراستها جميعًا 3. p. من الفقاريات واللافقاريات عبارة عن معقدات لبروتين الغشاء غير القابل للذوبان في الماء opsin و chromophore (الشبكية) المرتبط به. يمكن أن يوجد ألدهيد الشبكية أو فيتامين أ في شكلين ، شبكية 1 وشبكية 2.
حسب طبيعة حامل اللون 3. ينقسم العنصر إلى فئتين - رودوبسين (انظر) ، تحتوي على شبكية 1 ، وبورفيروبسين يحتوي على شبكية العين 2. تم العثور على رودوبسين في شبكية عين جميع الحيوانات البرية والبحرية ، ويوجد البورفيروبسين في شبكية عين حيوانات المياه العذبة. تحتوي بعض الأسماك والبرمائيات على 3 ص. تحتوي على شبكية العين في نفس الوقت! وشبكية العين. هناك محاولات لتصنيف 3. p. على أساس الاختلافات في opsins الخاصة بقضبان أو مخاريط شبكية العين. على سبيل المثال ، رودوبسين مركب من شبكية العين 1 مع قضيب أوبسين ، يودوبسين هو مركب شبكي 1 مع أوبسين مخروطي ، بورفيروبسين شبكي 2 مع قضيب أوبسين ، مركب شبكية مخروط أوبسين أشكال سيانوبسين. ومع ذلك ، من الصعب للغاية تصنيف 3. العناصر على أساس opsins ، حيث يوجد على الأقل خمسة opsins مختلفة.
من بين جميع العناصر الثلاثة المعروفة ، تم عزل رودوبسين من عيون الثور والضفدع والحبار بشكل كامل. نداءهم. الوزن (الكتلة) من 30-40 ألف ، يحتوي كل جزيء تقريبًا. 400 حمض أميني و chromophore واحد. إلى جانب ذلك ، فإن سلسلة oligosaccharide هي جزء من الجزيء 3. العنصر: 3 جذور جلوكوزامين ، 2 مانوز ، 1 غالاكتوز. تشكل الدهون (ch. arr. phospholipids) معقدًا قويًا مع الجزيء 3. ص. مع الاحتفاظ بخصائصها الطيفية الأساسية (انظر التحليل الطيفي) ، 3. العناصر التي لا تحتوي على دهون تفقد عددًا من العناصر المهمة وظيفيًا ، على سبيل المثال ، القدرة على التعافي.
شبكية العين النقية لها لون أصفر ، الحد الأقصى لطيف الامتصاص الخاص بها يقع في منطقة 370 نانومتر. Opsin عديم اللون ، ويكون الحد الأقصى للامتصاص في منطقة الأشعة فوق البنفسجية (حوالي 280 نانومتر). لون جزيء رودوبسين وردي محمر ، وطيف الامتصاص الأقصى تقريبًا. 500 نانومتر. لم يتلق سبب هذا التحول الطيفي القوي أثناء تكوين المجمع (من 370 إلى 500 نانومتر - ما يسمى التحول الباثوكرومي) تفسيرًا لا لبس فيه.
تلتقط الحدود القصوى لأطياف الامتصاص للرودوبسين والبورفيروبسين منطقة واسعة إلى حد ما من الطيف المرئي - من 433 إلى 562 نانومتر للرودوبسين ومن 510 إلى 543 نانومتر للبورفيروبسين. إذا كان البورفيروبسين يحتوي أيضًا على 3.p. مخاريط من الشرغوف من الضفدع والكارب وسلحفاة المياه العذبة ، أي السيانوبسين مع أقصى طيف امتصاص عند 620 نانومتر ، فإن هذه المنطقة تكون أوسع. لقد جعل تطوير طرق القياس الطيفي الدقيق من الممكن تحديد أطياف الامتصاص لأنواع عديدة من الخلايا المستقبلة للضوء في الحيوانات والبشر. وفقًا للبيانات التي تم الحصول عليها ، تحتوي 3. p من شبكية العين البشرية على الحد الأقصى لطيف الامتصاص التالي: قضبان 498 ، مخاريط حساسة للأزرق والأخضر والأحمر - 440 و 535 و 575 نانومتر ، على التوالي.
بدأت دراسة 3. ص باللغة الألمانية. الباحث H. Muller ، الذي وصف في عام 1851 كيف أن شبكية العين الأرجوانية الوردية المستخرجة من عين الضفدع تصبح مصفرة في الضوء أولاً ، ثم بيضاء. في عام 1877 ، وصف F. Boll أيضًا هذه الظاهرة ، وخلص إلى أن نوعًا من المواد الحساسة للضوء الأحمر توجد في الخلايا البصرية لشبكية العين وأن تغير لون هذه المادة يرتبط بآلية الرؤية. ميزة كبيرة في دراسة 3. p. تنتمي إلى Kühne (W. Kuhne ، 1877) ، وتمكن Krom من عزل 3. p. ودراستها بالتفصيل. أطلق على 3. p. المستخلص من قبله اللون الأرجواني البصري ، وأثبت طبيعته البروتينية ، ودرس بعض خصائصه الطيفية وتحولاته الضوئية ، واكتشف قدرة 3. p. على التعافي في الظلام. عامر قدم مساهمة كبيرة في دراسة 3. ص. عالم الكيمياء الحيوية وعالم وظائف الأعضاء J. Wald.
التحولات الضوئية للأصباغ البصرية. تحت تأثير الضوء في 3. ص ، تحدث دورة كيميائية ضوئية فيها. التحولات ، التي تستند إلى التفاعل الكيميائي الضوئي الأولي لأزمرة رابطة الدول المستقلة عبر الشبكية (انظر التماكب). في هذه الحالة ، يتم تعطيل الرابطة بين الكروموفور والبروتين. يمكن تمثيل تسلسل التحولات في 3. ص على النحو التالي: رودوبسين (حامل الكروم في شكل رابطة الدول المستقلة) -> prelumirhodopsin -> لوميرودوبسين -> ميتارودوبسين 1 -> ميتارودوبسين الثاني -> بروتين أوبسين -> كروموفور في شكل متحولة . تحت تأثير الإنزيم - الريتينول ديهيدروجينيز - يمر الأخير إلى فيتامين أ ، الذي يأتي من الأجزاء الخارجية للقضبان والمخاريط إلى خلايا الطبقة الصبغية للشبكية. عند سواد العين ، يحدث التجدد 3. p. ، لإجراء عملية قطع ، من الضروري وجود أيزومر لفيتامين أ رابطة الدول المستقلة ، والذي يعمل كمنتج أولي لتكوين حامل اللون (فيتامين أ ألدهيد). . مع نقص أو عدم وجود فيتامين (أ) في الجسم ، يمكن أن يتعطل تكوين رودوبسين ويتطور نتيجة لاضطراب رؤية الشفق ، ما يسمى. العمى الليلي (انظر Hemeralopia). في عملية التحول الضوئي للرودوبسين في مرحلة انتقال لوميرودوبسين إلى ميتارودوبسين الأول في خلية المستقبل يحدث استجابة لميض ساطع لما يسمى. مستقبلات مستقبلات مبكرة (قصيرة الكمون). في الوقت نفسه ، فهي ليست إشارة بصرية ، على الرغم من أنها يمكن أن تكون بمثابة أحد الاختبارات لدراسة آلية التحولات 3. ص في غشاء المستقبل الضوئي. القيمة الوظيفية هي ما يسمى. احتمال المستقبل المتأخر ، الفترة الكامنة إلى روجو (5-10 مللي ثانية) تتناسب مع وقت تكوين metarhodopsin II. من المفترض أن تفاعل انتقال metarhodopsin I إلى metarhodopsin II يوفر حدوث إشارة بصرية.
نظرًا لأن العناصر 3. يتغير لونها باستمرار في الضوء ، يجب أن تكون هناك آليات لاستعادتها المستمرة. بعضها سريع للغاية (تجديد ضوئي) ، والبعض الآخر سريع جدًا (كيميائي حيوي ، تجديد ، مظلم) ، والبعض الآخر بطيء (تخليق 3. ص. أثناء التجديد المستمر لغشاء المستقبل الضوئي في الخلية البصرية). التنكس الضوئي له قيمة فيزيول ، قيمة عند الحيوانات اللافقارية (على سبيل المثال ، في رأسيات الأرجل- الأخطبوط والحبار). في آلية الكيمياء الحيوية. التجديد 3. p. في الفقاريات ، يلعب دور مهم ، على ما يبدو ، إنزيم إيزوميراز (انظر) ، والذي يوفر أزمرة عبر الشبكية (أو عبر فيتامين أ) مرة أخرى في شكل ايزومير رابطة الدول المستقلة. ومع ذلك ، لا يوجد دليل قاطع على وجود مثل هذا الإنزيم. نفس رد الفعل لتكوين جزيء 3. ص في وجود 11-cis-isomer للشبكية و opsin في النظام يحدث بسهولة ، دون إنفاق الطاقة. تم العثور على قدرة رودوبسين المبيضة على تفاعل الفسفرة (انظر) ؛ من المفترض أن هذا التفاعل هو أحد الروابط في آلية التكيف الضوئي للخلية المرئية.
فهرس:أكرمان يو الفيزياء الحيوية ، العابرة. من الإنجليزية ، M. ، 1964 ؛ Willie K. and Det e V. Biology، trans. من الإنجليزية ، M. ، 1974 ، ببليوغرافيا ؛ Konev S. V. and Volotovsky I.D مقدمة في البيولوجيا الضوئية الجزيئية ، ص. 61 ، مينسك ، 1971 ؛ Ostrovsky M.A and Fedorovich I. B. التغييرات الضوئية في غشاء المستقبلات الضوئية ، في الكتاب: هيكل ووظائف biol ، الأغشية ، محرر. أ.س.تروشينا وآخرون ، ص. 224 ، M. ، 1975 ، ببليوغر ؛ فسيولوجيا النظم الحسية ، أد. جي في غيرشوني ، الجزء 1 ، ص. 88 ، L. ، 1971 ؛ الكيمياء الحيوية ووظائف الأعضاء للأصباغ البصرية ، أد. بواسطة H. Langer ، B. a. ، 1973 ؛ كتيب علم وظائف الأعضاء الحسية ، أد. بواسطة H. A.R Jung a. س ، ق. 7، pt 1-2، B.، 1972.
م. أ. أوستروفسكي.
صبغة بصرية الوحدة الهيكلية والوظيفية للغشاء الحساس للضوء للمستقبلات الضوئية (انظر المستقبلات الضوئية) لشبكية العين - القضبان والمخاريط. في Z. p. ، يتم تنفيذ المرحلة الأولى من الإدراك البصري - امتصاص كمات الضوء المرئي. يتكون جزيء Z. (الكتلة المولية حوالي 40000) من حامل للضوء ممتص للضوء و opsin ، وهو مركب من البروتين و phospholipids. إن Chromophore لجميع Z.P. هو ألدهيد فيتامين A 1 أو A 2 - شبكية أو 3-dehydroretinal. نوعان من opsin (قضيب ومخروط) ونوعين من شبكية العين ، عند دمجهم في أزواج ، يشكلون 4 أنواع من z.p. نانومتر) ، اليودوبسين (562 نانومتر) ، البورفيروبسين (522 نانومتر) وسيانوبسين (620 نانومتر). يتكون الرابط الكيميائي الضوئي الأساسي في آلية الرؤية (انظر الرؤية) من التشابك الضوئي للشبكية ، والذي يغير ، تحت تأثير الضوء ، تكوينه المنحني إلى شكل مسطح. يتبع هذا التفاعل سلسلة من العمليات المظلمة التي تؤدي إلى ظهور إشارة مستقبلات بصرية ، والتي تنتقل بعد ذلك بشكل متشابك إلى العناصر العصبية التالية في شبكية العين - الخلايا ثنائية القطب والأفقية. أشعل.:فسيولوجيا النظم الحسية ، الجزء الأول ، ل. ، 1971 ، ص. 88-125 (دليل علم وظائف الأعضاء)؛ والد ج. ، الأساس الجزيئي للإثارة البصرية ، "الطبيعة" ، 1968 ، v. 219. م. أ. أوستروفسكي.
الموسوعة السوفيتية العظمى. - م: الموسوعة السوفيتية. 1969-1978 .
تعرف على "الصبغة المرئية" في القواميس الأخرى:
وظيفية هيكلية. وحدة حساسة للضوء. أغشية المستقبلات الضوئية العصوية والمخروطية في شبكية العين. يتكون الجزيء 3. p من كروموفور ممتص للضوء و opsin من مركب من البروتين و phospholipids. يتم تمثيل Chromophore بفيتامين A1 ألدهيد ... ... القاموس الموسوعي البيولوجي
رودوبسين (اللون الأرجواني البصري) هو الصبغة البصرية الرئيسية في قضبان شبكية العين البشرية والحيوانية. يشير إلى بروتينات كروموبروتينات معقدة. يمكن أن تختلف تعديلات البروتين المميزة للأنواع البيولوجية المختلفة بشكل كبير ... ويكيبيديا
بصري (ه) الصباغ (ق)- انظر الصبغ الضوئي ... قاموسفي علم النفس
صبغة الشبكية الموجودة داخل القضبان ، والتي تشمل فيتامين (أ) الشبكية والبروتين. وجود رودوبسين في الشبكية ضروري للرؤية الطبيعية في الضوء الخافت. تحت تأثير الضوء ... ... المصطلحات الطبية
رودوبسين (رودوبسين) ، الأرجواني المرئي- صبغة شبكية (أرجوانية بصرية) موجودة داخل العصي ، والتي تشمل شبكية العين (الشبكية) فيتامين أ والبروتين. وجود رودوبسين في الشبكية ضروري للرؤية الطبيعية في الضوء الخافت. تحت… … القاموس التوضيحي للطب
- (أرجواني بصري) ، حساس للضوء. بروتين معقد صبغة بصرية للخلايا العصوية في شبكية العين لدى الفقاريات والبشر. يمتص كمية من الضوء (أقصى امتصاص حوالي 500 نانومتر) ، يتفكك R. علم الطبيعة. قاموس موسوعي
- (صبغة بصرية) ، بروتين عصي حساس للضوء لشبكية العين لدى الفقاريات والخلايا البصرية لللافقاريات. R. glycoprotein (مول. m. حوالي 40 ألف ؛ تتكون سلسلة polypeptide من 348 من بقايا الأحماض الأمينية) ، تحتوي على ... ... موسوعة كيميائية
- (من الكلمة اليونانية rhódon rose و ópsis vision) الأرجواني البصري ، الصبغة البصرية الرئيسية لقضبان شبكية الفقاريات (باستثناء بعض الأسماك والبرمائيات في المراحل الأولى من التطور) واللافقاريات. حسب المادة الكيميائية ... ... الموسوعة السوفيتية العظمى
- (أرجواني بصري) ، بروتين معقد حساس للضوء ، الصبغة البصرية الرئيسية للخلايا العصوية لشبكية العين في الفقاريات والبشر. امتصاص كمية من الضوء (أقصى امتصاص حوالي 500 نانومتر) ، يتحلل رودوبسين ويسبب ... ... قاموس موسوعي
المقال الرئيسي: Rods (شبكية العين) Rhodopsin (اسم أرجواني مرئي قديم ولكنه لا يزال مستخدمًا) هو الصباغ المرئي الرئيسي. تحتوي أعواد شبكية العين على اللافقاريات البحرية والأسماك وكلها تقريبا الأرضية ... ... ويكيبيديا
25-10-2014, 13:04
تُمتص الكميات الخفيفة في المستقبلات بواسطة جزيئات متخصصة - أصباغ ضوئية بصرية. تم اكتشاف الأصباغ البصرية بشكل مستقل من قبل الفيزيولوجيين الألمان F. Boll و W. Kuehne في 1877-1879. لاحظ F. Boll أن شبكية العين المعزولة عن الزجاج المرئي للضفدع تبدو حمراء في البداية ، ثم تتلاشى في الضوء ، وتصبح صفراء ، وفي النهاية عديمة اللون تمامًا.
وجد دبليو كوهني أنه في عين الحيوان التي تعمل بشكل طبيعي ، يتم استعادة لون شبكية العين بعد الإضاءة الشديدة بالضوء إذا تم وضع الحيوان مرة أخرى في الظلام. وبناءً على هذه الملاحظات استنتج أن هناك مادة حساسة للضوء (صبغة) في شبكية العين ينخفض تركيزها في الضوء ويعاد في الظلام.
أصباغ بصرية- هذه جزيئات معقدة من البروتينات الدهنية ، والتي تتكون في الفقاريات واللافقاريات من جزأين رئيسيين: حامل اللون (جزء التلوين من الجزيء الذي يحدد لون المستقبل عند الإضاءة) وبروتين (أوبسين). يحدد Chromophore الحد الأقصى وشدة امتصاص الضوء في الصباغ وهو ألدهيد للكحول - فيتامينات A1 و A2.
أسماء هذه الألدهيدات هي Retinal-1 و Retinal-2. يؤدي وجود رابطة مزدوجة إضافية في الشبكية 2 إلى تحول الحد الأقصى لطيف الامتصاص إلى منطقة الطول الموجي الطويل. تلتصق الشبكية بالأوبسين ، وهي طفرة بروتينية توجد فقط في المستقبلات الضوئية. يتم عزل قضيب opsin ، scotopsin ، والمخاريط ، photopsin. يتكون Scotopsin من 230-270 من بقايا الأحماض الأمينية ، والتي لم يتم تحديد تسلسلها بعد.
لا يُعرف سوى القليل عن photopsin: لا توجد سوى بيانات حول تكوينه الحلزوني. الجزء الفعلي الممتص للضوء من جزيء الصبغة ، الشبكية ، هو نوع من أصباغ الكاروتين ، وهو الأكثر شيوعًا في التمثيل الضوئي. أنسجة النباتات والحيوانات.
يتم تحديد الخصائص الطيفية للأصباغ من خلال مجموعات من أحد شبكية العين مع مجموعة متنوعة أو أخرى من opsins ، والتي يحدد تنوعها تنوع الأصباغ البصرية في الحيوانات المختلفة. وهكذا ، فإن الجمع بين سكوتوبسين مع شبكية العين 1 يؤدي إلى تكوين صبغة قضيب - رودوبسين مع أقصى امتصاص عند = 500 نانومتر ، وتشكيله مع شبكية 2 - صبغة قضيب أخرى - البورفيروبسين مع أقصى امتصاص عند؟ = 525 نانومتر. مجموعات من شبكية العين 1 مع نوع مختلفالفوتوبسين في شبكية العين للإنسان والقرود تشكل أصباغ مخروطية مع امتصاص قصوى عند؟ = 445 نانومتر ،؟ = 535 نانومتر و؟ \ u003d 570 نانومتر ، تسمى سيانولاب ، كلورولاب وإريثرولاب ، على التوالي.
يتم تحديد خصائص امتصاص الضوء للأصباغ بدقة من خلال تفاعل iopsin chromophore: الحد الأقصى لامتصاص chromophore و opsin ، مأخوذ بشكل منفصل ، موضعي في المنطقة؟ = 278 نانومتر (شبكية -1) و؟ = 378 نانومتر (سكوتوبسين) ، في حين أن مركبهم - رودوبسين - لديه أقصى امتصاص عند؟ = 500 نانومتر. الحد الأقصى للامتصاص هو أحد معلمات الخصائص الطيفية للصبغة ، والتي تحدد بشكل عام كفاءة الامتصاص بواسطة صبغة كمات الضوء (الفوتونات) ذات الأطوال الموجية المختلفة (الشكل 3.1.4 أ).
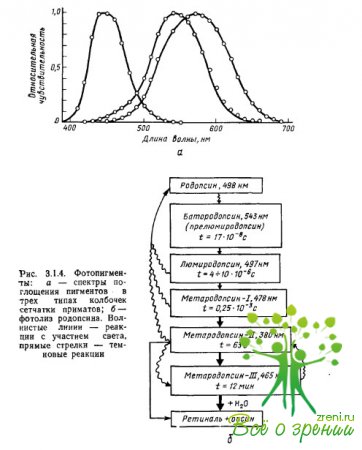
تم إجراء القياسات الأولى لأطياف الامتصاص للأصباغ في المخاريط الفردية لشبكية العين للقرود والبشر بواسطة براون ووالد وماركس وآخرون ، باستخدام طريقة قياس الطيف الضوئي الدقيق التي تم تطويرها خصيصًا لهذا الغرض. تم وضع المستحضر الشبكي تحت المجهر ، مما جعل من الممكن ، تحت التحكم البصري ، تركيز شعاع من الضوء بطول موجي واحد أو آخر على الجزء الخارجي من المستقبل الضوئي ، الذي يحتوي على الصباغ.
بعد ذلك ، بالنسبة لكل طول موجي ، تم أخذ قياسات منفصلة لكمية الضوء التي تمر عبر المخروط ولم يمتصها (الفرق بين كمية الضوء التي يتم توفيرها للمخروط وكمية الضوء المنقول بواسطته تميز بكفاءة امتصاص فوتونات ذات طول موجي معين بواسطة الصباغ). تم تكرار القياسات بعد تلاشي الصباغ نتيجة الإضاءة الشديدة (القياسات المرجعية). نتيجة لطرح السلسلة الثانية من القياسات من الأولى ، تم الحصول على طيف الامتصاص التفاضلي للصبغة كدالة لحساسية الضوء على طول موجة الإشعاع.
من التين. 4.1.3a يمكن ملاحظة أن الأصباغ لها نطاق عريض وأطياف امتصاص متداخلة بشدة. تتمتع جميع الصبغات الضوئية بخاصية امتصاص قصوى إضافية للكاروتينات (ما يسمى الذروة nis أو "؟ -peak") ، تساوي 2/3 من الحد الأقصى الرئيسي. بالنسبة للأصباغ ، يتم تحديد أقصى امتصاص رئيسي لها في الأجزاء ذات الطول الموجي القصير والمتوسط من الطيف ، تقع ذروة رابطة الدول المستقلة في منطقة الأشعة فوق البنفسجية ولا تؤثر على تحليل الإشعاع من الطيف المرئي. علاوة على ذلك ، عند إنشاء وظائف الحساسية الطيفية للأصباغ ، يتم تحويل مقياس الطول الموجي (محور الإحداثي) إلى مقياس تردد ، ثم أطياف الامتصاص لجميع الأصباغ ، بما في ذلك opsins المختلفة ، ولكن نفس الشبكية (على سبيل المثال ، شبكية العين -1) ، سيكون لها نفس الشكل ونفسه.
مع هذا العرض التقديمي للبيانات ، الذي اقترحه Dartnall لأول مرة "(1953) للأصباغ القائمة على الشبكية 1 ، تختلف أطياف الامتصاص للأصباغ الضوئية المختلفة فقط في موضع الحد الأقصى. وبعد ذلك ، بمعرفة الحد الأقصى لامتصاص الصباغ ، يمكننا استعادة شكل طيف الامتصاص الخاص به ، أولاً في إحداثيات "حساسية تردد الإشعاع" ، ثم باستخدام النسبة c = f وفي الإحداثيات "الطول الموجي - الحساسية".
هذه الطريقة لاستعادة طيف الامتصاص لصبغة غير معروفة من البيانات فقط عند الحد الأقصى لها تسمى طريقة nomogram. تُستخدم طريقة الرسوم البيانية أيضًا على نطاق واسع في الفسيولوجيا العصبية للرؤية اللونية عند حل مشكلة عدد ونوع أجهزة الكشف الضوئية المتقاربة إلى خلية عصبية حساسة للون أو أخرى: تتم مقارنة وظيفة الحساسية الطيفية للخلايا العصبية مع مخطط واحد أو آخر ( أو مزيجهم).
يرتبط تنوع الصبغات الضوئية في المملكة الحيوانية بتنوع الموائل البيئية. في الأسماك والبرمائيات ، قد تحتوي شبكية العين على كل من رودوبسين وبورفيروبسين ، حيث تتغير نسبتهما خلال حياة الفرد ؛ في الأسماك الشاذة ، فإن استبدال الرودوبسين بالبورفيروبسين يسبق الانتقال من المياه المالحة إلى المياه العذبة والعكس صحيح. إن ارتباط تكوين الصباغ ببيئة الموائل ليس صارمًا: يمكن أن تحدث التغييرات في تكوين الصباغ عن طريق التغيرات الموسمية والإيقاعات اليومية.
أزمرة ضوئية.
يتم تحديد تفاعل الصبغة الضوئية مع الضوء من خلال عدد الكميات الممتصة ، بغض النظر عن الطول الموجي وطاقة الإشعاع: على سبيل المثال ، تلك التي يمتصها رودوبسين. 10 كمات من الضوء في؟ \ u003d 430 نانومتر تسبب نفس التغييرات الهيكلية فيه (الشكل 3.1.46) ، وكذلك 10 الكميات الممتصة من الضوء عند؟ = 500 نانومتر.
ويتم تحديد الانتقائية الطيفية (طيف الامتصاص) للصبغة فقط من خلال الاحتمالات المختلفة لامتصاص كمات الضوء من أجزاء مختلفة من الطيف المرئي. وهكذا ، فإن الأصباغ البصرية ، وفي النهاية المستقبلات الضوئية ، تعمل بمثابة "عدادات فوتونات الضوء" ، تختلف عن بعضها البعض فقط في احتمال امتصاص فوتونات ذات أطوال موجية مختلفة.
عندما يمتص جزيء واحد من رودوبسين كمية واحدة من الضوء ، يحدث تغيير في التكوين المكاني لجزيء واحد من شبكية العين - أزمرة ضوئية ، والتي تتكون من تحويل شكل 11 سم من الشبكية إلى تحول كامل (الشكل 3.1.4 ب) .

تصاحب عملية الأيزومرة الضوئية دورة من التفاعلات الكيميائية الضوئية ، وحصل ج. فالد على جائزة نوبل لفك الشفرة في عام 1930. المنتجات النهائية من أزمرة ضوئية هي تماما traxretinal و opsin. جميع التفاعلات الوسيطة حتى خطوة metarhodopsin-II قابلة للانعكاس: يمكن تحويل نواتج هذه التفاعلات مرة أخرى إلى رودوبسين عبر أزمرة حبيبية عكسية للشبكية.
هذا يعني أنه لا توجد تغييرات توافقية كبيرة تحدث في جزيء الصباغ قبل metarhodopsin-II. في مرحلة metarhodopsin-II ، تنفصل الشبكية عن جزء البروتين في الجزيء. من بين جميع مراحل الأزمرة ، يحتاج الضوء فقط المرحلة الأولى - تحويل رودوبسين إلى بريلوميرودوبسين (باثورودوبسين). جميع ردود الفعل الأخرى تستمر في الظلام. تتم عملية الأيزومرة الضوئية بالمثل في أصباغ المخروط.
وبالتالي ، فإن الأيزومرة الضوئية هي آلية تحفيز (بدء) جزيئية لاستقبال الضوء ، والتي تتكون من تغيير التكوين المكاني لجزيء الصباغ المرئي. يوضح هذا الأخير سبب اختيار الطبيعة للكاروتينات كصبغة بصرية: إن وجود روابط مزدوجة في شبكية العين يحدد إمكانية تشابهها و ؛ تفاعله العالي. حول كل رابطة مزدوجة ، يمكن لأجزاء من الجزيء أن تدور وتنحني في الفضاء. هذا النموذج هو الأقل استقرارًا والأكثر حساسية لدرجة الحرارة والضوء. وجدت في الطبيعة أنواع مختلفةشبكية العين - أشكال 7 ، 9 ، 11 ، 13-cis ، 9.13-dicis ، ولكن في الأصباغ البصرية ، تكون شبكية العين دائمًا في شكل 11-cis.
يحدث إعادة تركيب الصباغ في المستقبلات الضوئية بشكل مستمر في الضوء وفي الظلام بمشاركة إنزيم إيزوميراز الريتينين ويتكون من أزمرة عكسية للريتينول من التحويل إلى شكل 11-cis. في المخاريط ، يقع هذا الإنزيم في المستقبلات نفسها ، في قضبان ، في ظهارة الصباغ ، حيث يمر عبر الريتينول بعد الانفصال عن الأوبسين وحيث يتشابه في شكل 11 رابطة الدول المستقلة. في هذه الحالة ، يتم إعادة استخدام فيتامين أ في شبكية العين ، ويتم تصنيع البروتين في ريبوسومات الجزء الداخلي.
من المفترض أن يحدث إعادة تركيب 11-cis-retinal مع opsin تلقائيًا. تحتوي الظهارة الصبغية على حوالي 11٪ من فيتامين أ (الريتينول) من أصل 13٪ في العين بأكملها. يتكون فيتامين أ في الكبد عن طريق كسر سلسلة الكاروتين الموجودة في الطعام إلى جزأين وإضافة الماء.
يتم نقل فيتامين أ بواسطة بروتين خاص مرتبط بالريتينول إلى الظهارة الصباغية ، حيث يتأكسد إلى شبكية العين. مع نقص فيتامين أ ، يحدث ما يسمى "العمى الليلي" - انخفاض في الحساسية المطلقة للضوء ، والتي تؤثر بشكل خاص على الرؤية عند الغسق ، وتتحول إلى عمى دائم بسبب تدمير بروتين غير مستقر في حالة حرة. لذلك ، مع مرض "العمى الليلي" يوصى بتناول الجزر الذي يحتوي على فيتامين أ - بيتا كاروتين.
يحتوي كل مستقبل ضوئي على صبغة ضوئية واحدة فقط ، تتميز بطيف امتصاص واحد أو آخر. في هذا الصدد ، يتم عزل المخاريط ذات الطول الموجي القصير والمتوسط والطويل ، والتي تحتوي على أصباغ في الرئيسيات ذات الحد الأقصى للامتصاص ، على التوالي ، عند 445 نانومتر و 535 نانومتر و 570 نانومتر. في أسماك المياه العذبةيحتوي المخروط ذو الطول الموجي الطويل على صبغة ذات امتصاص أقصى عند 620 نانومتر ، والذي يرتبط بشكل التوزيع الطيفي للضوء في بيئتها.
يشار إلى هذه المخاريط أحيانًا على أنها مستقبلات حساسة للأزرق والأخضر والأحمر ، وفقًا لتقليد يعود إلى فرضية Young-Helmholtz المكونة من ثلاثة مكونات. ولكن منذ النصف الثاني من القرن العشرين ، عندما وجد أنه لا يوجد مستقبِل للضوء في حد ذاته يقوم بتحليل طيفي ، ولكنه يتفاعل فقط مع عدد الفوتونات الممتصة ، بغض النظر عن طول موجة الإشعاع ، تُستخدم هذه الأسماء اللونية للمستقبلات فقط في صورة مجازية حاسة.
تصنيف العصي ، على سبيل المثال ، في الضفدع ، إلى "أخضر" و "أحمر" في بعض الحالات لا يعتمد على الحساسية الطيفية للصبغة الموجودة فيها ، ولكن على لون أجسام المستقبل في الضوء المنقول. وهكذا ، تحتوي القضبان "الخضراء" على صبغة ذات امتصاص أقصى عند 432 نانومتر ، وبالتالي ، عند إضاءتها بالضوء الأبيض ، فإنها تمتص إشعاع الموجة القصيرة ، وتمرير جميع الأطوال الموجية الأخرى ، وتبدو مخضرة عند التحكم فيها بصريًا.
في شبكية العين ، لوحظ وجود علاقة بين طول المخروط والنوع الطيفي للصبغة الموجودة فيه: أقصرهما يحتوي على صبغة قصيرة الموجة ، والأطول يحتوي على صبغة طويلة الموجة. اقترح إيبرل أن هذه قد تكون إحدى الآليات للتعامل مع الانحراف اللوني. بسبب الانحراف اللوني ، فإن الصورة الحادة لإشعاع الموجة المتوسطة تقع أعمق (أبعد من العدسة) من الصورة الحادة لإشعاع الموجة القصيرة ، ويوجد تركيز إشعاع الموجة الطويلة أبعد من ذلك.
يكفي ترتيب مستقبلات ذات موجات قصيرة ومتوسطة وطويلة عند المستويات المناسبة بحيث تركز جميع أجزاء الإشعاع الطيفي بشكل متساوٍ على المستقبلات. ربما يفسر هذا حقيقة أنه في شبكية الأسماك ، تحتوي المخاريط المفردة ذات الأجزاء القصيرة على صبغة ذات طول موجي قصير ، بينما في المخروط المزدوج ، يحتوي الجزء الأطول على صبغة طويلة الموجة ، بينما يحتوي الجزء الأقصر على صبغة قصيرة أو صبغة متوسطة الطول الموجي. تحتوي المخاريط المزدوجة ذات الأجزاء المتساوية في الطول على نفس الصبغة.
ωπς - عين) - اسم شائععدة أصباغ بصرية للإنسان وبعض الثدييات. تتكون هذه الأصباغ من جزيء بروتين مرتبط بالكروموفور في شبكية العين. تحتوي على مخاريط شبكية العين وتوفر رؤية ملونة على عكس صبغة بصرية أخرى - رودوبسين المسؤولة عن رؤية الشفق.لقد ثبت أن تكوين الأصباغ المرئية يشمل opsins. تختلف opsins المختلفة في تكوين الأحماض الأمينية ، وتمتص الضوء بأطوال موجية مختلفة قليلاً مثل الجزيئات المرتبطة بالشبكية.
تم اكتشاف وجود صبغة مخروطية لأول مرة (بشكل غير مباشر) بواسطة جورج والد ، الذي أطلق عليها اسمها. يودوبسين. . في عام 1967 حصل على جائزة نوبل في علم وظائف الأعضاء أو الطب عن هذه الأعمال.
حتى هيلمهولتز يعتقد أنه في "الجهاز الطرفي لألياف العصب البصري" (المستقبلات الضوئية للشبكية) يجب أن يكون هناك ثلاثة أنواع من المواد المتحللة ضوئيًا والتي لها حساسية مختلفة فيما يتعلق اجزاء مختلفةنطاق. .
وفقًا لنظرية الرؤية المكونة من ثلاثة عناصر السائدة في العلم الحديث ، يُعتقد أن هناك ثلاثة أنواع من هذا الصباغ ، وتحتوي شبكية العين ، على التوالي ، على ثلاثة أنواع من الأقماع الحساسة للضوء الأزرق والأخضر والأحمر. وفقًا لذلك ، يتكون اليودوبسين الموجود في مخاريط العين من ثلاثة أصباغ - كلورولاب وإريثرولاب وسيانولاب ؛ أولهم يمتص الأشعة المقابلة للأصفر والأخضر (نطاق الامتصاص 450-630 نانومتر) ، والثاني - الأصفر والأحمر (500-700 نانومتر) والثالث - الأزرق والأخضر (500-700 نانومتر) الجزء المرئي نطاق.
أنواع الأصباغ البصرية
تم إجراء المحاولات الأولى للعثور على ثلاثة أصباغ ، وكما هو متوقع ، ثلاثة أنواع من المخاريط (بناءً على افتراضات فرضية الرؤية المكونة من ثلاثة مكونات أن كل مخروط يحتوي على صبغة واحدة فقط) تم إجراؤها بواسطة Rushton ، الذي أتقن تقنية قياس الكثافة في الجسم الحي قياس معاملات امتصاص الضوء بأطوال موجية مختلفة - في طبقة المستقبلات الضوئية للشبكية. لقد ثبت أن تشوهات اللون تفتقر إلى أحد الصبغات الموجودة في الأشخاص ذوي الرؤية الطبيعية: "إرثرولاب" (بحد أقصى حوالي 585 نانومتر) في البروتانوب و "كلورولاب" (بحد أقصى حوالي 540 نانومتر) في deuteranop.
وتجدر الإشارة إلى أنه عند استخدام مصطلح "المستقبل" ، في بعض الحالات ، يتم اعتبار المجموعة الكاملة من المستقبلات الضوئية التي لها نفس الحساسية الطيفية كواحد المتلقي؛ في حالات أخرى ، السؤال هو ما إذا كان كل مخروط نقري يحتوي على ثلاثة المتلقيأو واحد فقط. في الوقت نفسه ، لا يتم انتهاك صرامة مفهوم "المتلقي" ، والذي في هذه الحالة لا يتضمن سمات مورفولوجية محددة.
كانت الخطوة التالية في هذا الاتجاه هي دراسة الصبغات الضوئية الموجودة في المخاريط البشرية ومخاريط المكاك. أحجام المخاريط النقرة صغيرة جدًا بحيث لا تكون موضوعًا للدراسة ، وجميع البيانات التي تم الحصول عليها تتعلق فقط بالمخاريط parafoveal. يبدو أن كل مخروط ، على الأقل المخروطي الخارج ، يحتوي على صبغة واحدة فقط ، أو في الغالب واحدة منها.
الأساليب الحديثة لدراسة التصاميم الضوئية المخروطية
قياس كثافة خلايا الشبكية
→ قياس الكثافة ، قد يكون على النحو التالي:
إذا كانت المحاولات الأولى للعثور على ثلاثة أصباغ ، وكما هو متوقع ، تم إجراء ثلاثة أنواع من الأقماع بواسطة Rushton ، الذي أتقن التقنية قياس الكثافةلقياس معاملات امتصاص الضوء بأطوال موجية مختلفة - في طبقة المستقبلات الضوئية في شبكية العين ، وتبين أن تشوهات اللون تفتقر إلى أحد الأصباغ التي يمتلكها الأشخاص ذوو الرؤية الطبيعية: "إريثرولاب" (بحد أقصى حوالي 585 نانومتر) في البروتانوب و " chlorolab "(بحد أقصى حوالي 540 نانومتر) - في deuteranop ، الآن بمساعدة طرق خاصة لقياس ضغط الدم باستخدام مقاييس كثافة حديثة ، تمكن العلماء من تحديد عمل المخاريط والقضبان في حالة النشاط الطبيعي وتشخيص أمراضهم.
أنظر أيضا
مصادر
المؤلفات
- Khokhlova TV الأفكار الحديثة حول رؤية الثدييات // مجلة علم الأحياء العام. المجلد 73 ، 2012. العدد 6 ، نوفمبر-ديسمبر. صفحة 418-434.



