pigments visuels. photoréception. Laquelle des coquilles du globe oculaire est transparente à l'avant. Le corps genouillé latéral est une structure
PIGMENTS VISUELS(lat. pigmentum paint) - pigments photosensibles des photorécepteurs de la rétine. Percevant l'énergie d'une impulsion lumineuse, 3. les objets subissent un cycle photochimique complexe. transformations, à la suite desquelles un récepteur visuel séparé de la rétine, contenant 3. p (un cône ou une tige), passe dans un état excité et transmet les informations reçues le long du nerf optique à c. n.m. à partir de. Étant la principale partie structurelle et fonctionnelle de la membrane photoréceptrice des cellules visuelles de la rétine, 3. p. rôle clé dans les mécanismes de la vision (voir).
Nomenclature et structure pigments visuels. Tous les 3. p étudiés de vertébrés et d'invertébrés sont des complexes de l'opsine, une protéine membranaire insoluble dans l'eau, et du chromophore (rétinien) qui lui est associé. Le rétinal, ou aldéhyde de vitamine A, peut exister sous deux formes, rétinal1 et rétinal2.
De par la nature d'un chromophore 3. l'élément est divisé en deux classes - les rhodopsines (voir), contenant du rétinal1, et les porphyropsines contenant du rétinal2. Les rhodopsines se trouvent dans la rétine de l'œil de tous les animaux terrestres et marins, les porphyropsines se trouvent dans la rétine des yeux des animaux d'eau douce. Certains poissons et amphibiens ont en même temps 3 p contenant de la rétine ! et rétinienne. Il existe des tentatives de classification de 3.p sur la base des différences d'opsines spécifiques aux bâtonnets ou aux cônes de la rétine. Par exemple, la rhodopsine est un complexe de rétinal1 avec de l'opsine en bâtonnet, l'iodopsine est un complexe de rétinal1 avec de l'opsine en cône, la porphyropsine est du rétinal2 avec de l'opsine en bâtonnet, le complexe rétinal-cône d'opsine forme de la cyanopsine. Cependant, il est extrêmement difficile de classer 3. les éléments sur la base des opsins, car il existe au moins cinq opsins différents.
De tous les éléments connus, les rhodopsines isolées des yeux d'un taureau, d'une grenouille et d'un calmar ont été les plus étudiées. Leur plaidoyer. poids (masse) de l'ordre de 30 à 40 000, chaque molécule contient env. 400 acides aminés et un chromophore. De plus, la chaîne oligosaccharidique est incluse dans la molécule de 3. p. : 3 radicaux glucosamine, 2 mannose, 1 galactose. Les lipides (ch. arr. phospholipides) forment un complexe fort avec la molécule 3. p. Tout en conservant leurs propriétés spectrales de base (voir Analyse spectrale), 3. les éléments sans lipides perdent un certain nombre de propriétés importantes sur le plan fonctionnel, par exemple la capacité de récupération.
Le rétinal pur a une couleur jaune, le maximum de son spectre d'absorption se situe aux alentours de 370 nm. L'opsine est incolore, le maximum d'absorption se situe dans la région ultraviolette (environ 280 nm). La couleur de la molécule de rhodopsine est rose rougeâtre, le spectre d'absorption maximal est d'env. 500 nm. La raison d'un tel décalage spectral lors de la formation du complexe (de 370 à 500 nm - le soi-disant décalage bathochromique) n'a pas encore reçu d'explication sans ambiguïté.
Les maxima des spectres d'absorption des rhodopsines et des porphyropsines capturent une région assez large du spectre visible - de 433 à 562 nm pour les rhodopsines et de 510 à 543 nm pour les porphyropsines. Si les porphyropsines incluent également les cônes 3.p. du têtard d'une grenouille, d'une carpe et d'une tortue d'eau douce, c'est-à-dire la cyanopsine avec un spectre d'absorption maximal à 620 nm, alors cette région est encore plus large. Le développement de méthodes de microspectrophotométrie a permis de déterminer les spectres d'absorption de nombreux types de cellules photoréceptrices uniques chez les animaux et les humains. Selon les données obtenues, 3 p de la rétine humaine ont les maxima de spectre d'absorption suivants : bâtonnets 498, cônes sensibles au bleu, au vert et au rouge - 440, 535 et 575 nm, respectivement.
L'étude de 3. P. a commencé en allemand. le chercheur H. Muller, qui en 1851 a décrit comment la rétine rose-violet extraite de l'œil d'une grenouille devient d'abord jaunâtre à la lumière, puis blanchâtre. En 1877, F. Boll a également décrit ce phénomène, concluant qu'une sorte de substance sensible à la lumière rouge est située dans les cellules visuelles de la rétine et que la décoloration de cette substance est associée au mécanisme de la vision. Un grand mérite dans l'étude de 3. P. appartient à Kuhne (W. Kuhne, 1877), Krom a réussi à isoler 3. P. et à les étudier en détail. Il a appelé le 3.p extrait par lui violet visuel, a établi sa nature protéique, a étudié certaines de ses propriétés spectrales et phototransformations, a découvert la capacité de 3.p à se rétablir dans l'obscurité. Amer. a apporté une grande contribution à l'étude de 3. p. biochimiste et physiologiste J. Wald.
Phototransformations des pigments visuels. Sous l'influence de la lumière sur 3. p., un cycle photochimique se produit en eux. transformations, qui sont basées sur la réaction photochimique primaire d'isomérisation cis-trans du rétinal (voir Isomérie). Dans ce cas, la liaison entre le chromophore et la protéine est rompue. La séquence des transformations de 3. p peut être représentée comme suit : rhodopsine (le chromophore est sous forme cis) -> prélumirhodopsine -> lumirhodopsine -> métarhodopsine I -> métarhodopsine II -> protéine opsine -> chromophore sous forme trans . Sous l'influence de l'enzyme - la rétinol déshydrogénase - cette dernière passe dans la vitamine A, qui provient des segments externes des bâtonnets et des cônes dans les cellules de la couche pigmentaire de la rétine. Lorsque l'œil est assombri, la régénération se produit 3. p., pour la mise en œuvre d'une coupe, la présence d'un isomère cis de la vitamine A, qui sert de produit de départ pour la formation d'un chromophore (vitamine A aldéhyde), est nécessaire. Avec un manque ou une absence de vitamine A dans le corps, la formation de rhodopsine peut être perturbée et se développer à la suite d'un trouble de la vision crépusculaire, le soi-disant. cécité nocturne (voir Héméralopie). Dans le processus de phototransformation de la rhodopsine au stade de la transition de la lumirhodopsine à la métarhodopsine I dans la cellule réceptrice se produit en réponse à un flash lumineux de la soi-disant. potentiel de récepteur précoce (courte latence). En même temps, ce n'est pas un signal visuel, bien qu'il puisse servir de test pour étudier le mécanisme des transformations de 3. p dans la membrane photoréceptrice. La valeur fonctionnelle est la soi-disant. potentiel récepteur tardif, la période de latence to-rogo (5-10 msec) est proportionnelle au temps de formation de la métarhodopsine II. On suppose que la réaction de la transition de la métarhodopsine I à la métarhodopsine II fournit l'occurrence signal visuel.
Étant donné que 3. les objets sont continuellement décolorés à la lumière, il doit y avoir des mécanismes pour leur restauration constante. Certains d'entre eux sont extrêmement rapides (photorégénération), d'autres sont assez rapides (biochimique, régénération, Dark), d'autres sont lents (synthèse de 3. p. Lors du renouvellement constant de la membrane photoréceptrice dans la cellule visuelle). La photorégénération a fiziol, la valeur chez les animaux invertébrés (par exemple, chez céphalopodes- calmar, poulpe). Dans le mécanisme de la biochimie. régénération 3. p.chez les vertébrés, un rôle important est apparemment joué par l'enzyme isomérase (voir), qui assure l'isomérisation du trans-rétinal (ou trans-vitamine A) à nouveau sous la forme cis-isomère. Cependant, il n'existe aucune preuve définitive de l'existence d'une telle enzyme. La même réaction de formation d'une molécule de 3.p en présence de l'isomère 11-cis du rétinal et de l'opsine dans le système se produit facilement, sans dépense d'énergie. La capacité de la rhodopsine blanchie à la réaction de phosphorylation est trouvée (voir); on suppose que cette réaction est l'un des maillons du mécanisme d'adaptation à la lumière de la cellule visuelle.
Bibliographie: Ackerman Yu. Biophysique, trad. de l'anglais, M., 1964 ; Willie K. et Det e V. Biology, trad. de l'anglais, M., 1974, bibliographie ; Konev S. V. et Volotovsky I. D. Introduction à la photobiologie moléculaire, p. 61, Minsk, 1971; Ostrovsky M. A. et Fedorovich I. B. Modifications photoinduites de la membrane photoréceptrice, dans le livre : Structure et fonctions du biol, membranes, éd. A. S. Troshina et autres, p. 224, M., 1975, bibliogr.; Physiologie des systèmes sensoriels, éd. G.V. Gershuni, partie 1, p. 88, L., 1971; Biochimie et physiologie des pigments visuels, éd. par H. Langer, B. a. o., 1973 ; Manuel de physiologie sensorielle, éd. par H.A.R. Jung a. o., v. 7, parties 1-2, B., 1972.
M. A. Ostrovsky.
pigment visuel unité structurelle et fonctionnelle de la membrane sensible à la lumière des photorécepteurs (voir photorécepteurs) de la rétine - bâtonnets et cônes. Dans Z. p., la première étape de la perception visuelle est réalisée - l'absorption des quanta de lumière visible. La molécule Z. (masse molaire d'environ 40 000) est constituée d'un chromophore absorbant la lumière et d'une opsine, un complexe de protéines et de phospholipides. Le chromophore de tous les Z. p. est l'aldéhyde de la vitamine A 1 ou A 2 - rétinienne ou 3-déhydrorétinienne. Deux types d'opsine (tige et cône) et deux types de rétine, lorsqu'ils sont combinés par paires, forment 4 types de z.p. nm), iodopsine (562 nm), la porphyropsine (522 nm) et la cyanopsine (620 nm). Le principal lien photochimique dans le mécanisme de la vision (Voir Vision) consiste en la photoisomérisation de la rétine qui, sous l'action de la lumière, change sa configuration courbe en une configuration plate. Cette réaction est suivie d'une chaîne de processus sombres conduisant à l'apparition d'un signal de récepteur visuel, qui est ensuite transmis par voie synaptique aux éléments nerveux suivants de la rétine - cellules bipolaires et horizontales. Litt. : Physiologie des systèmes sensoriels, partie 1, L., 1971, p. 88-125 (Manuel de physiologie); Wald G., La base moléculaire de l'excitation visuelle, "Nature", 1968, v. 219. M. A. Ostrovsky.
Grande Encyclopédie soviétique. - M. : Encyclopédie soviétique. 1969-1978 .
Voyez ce qu'est "Pigment visuel" dans d'autres dictionnaires :
Structurellement fonctionnel. unité sensible à la lumière. membranes photoréceptrices en bâtonnets et cônes dans la rétine. La molécule 3. p est constituée d'un chromophore absorbant la lumière et d'une opsine d'un complexe de protéines et de phospholipides. Le chromophore est représenté par la vitamine A1 aldéhyde ... ... Dictionnaire encyclopédique biologique
La rhodopsine (violet visuel) est le principal pigment visuel des bâtonnets de la rétine humaine et animale. Fait référence aux protéines complexes chromoprotéines. Les modifications protéiques caractéristiques des différentes espèces biologiques peuvent varier considérablement ... Wikipedia
PIGMENT(S) VISUEL(E)- Voir photopigment... dictionnaire en psychologie
Le pigment rétinien contenu à l'intérieur des bâtonnets, qui comprend de la vitamine A et des protéines rétiniennes (rétiniennes). La présence de rhodopsine dans la rétine est nécessaire pour une vision normale en faible lumière. Sous l'influence de la lumière ... ... termes médicaux
RHODOPSINE (RHODOPSINE), VIOLET VISUEL- (violet visuel) le pigment rétinien contenu à l'intérieur des sticks, qui comprend de la vitamine A et des protéines rétiniennes (rétiniennes). La présence de rhodopsine dans la rétine est nécessaire pour une vision normale en faible lumière. En dessous de… … Dictionnaire explicatif de la médecine
- (violet visuel), photosensible. protéine complexe, pigment visuel des cellules en bâtonnets de la rétine des vertébrés et des humains. Absorbant un quantum de lumière (absorption maximale d'environ 500 nm), R. se désintègre et provoque une excitation ... ... Sciences naturelles. Dictionnaire encyclopédique
- (pigment visuel), protéine bâtonnet photosensible de la rétine des vertébrés et des cellules visuelles des invertébrés. R. glycoprotéine (mol. m. environ 40 000; chaîne polypeptidique constituée de 348 résidus d'acides aminés), contenant ... ... Encyclopédie chimique
- (du grec rhódon rose et ópsis vision) violet visuel, principal pigment visuel des bâtonnets de la rétine des vertébrés (à l'exception de certains poissons et amphibiens aux premiers stades de développement) et des invertébrés. Selon le produit chimique ... ... Grande Encyclopédie soviétique
- (violet visuel), une protéine complexe sensible à la lumière, principal pigment visuel des cellules en bâtonnets de la rétine chez les vertébrés et l'homme. Absorbant un quantum de lumière (l'absorption maximale est d'environ 500 nm), la rhodopsine se décompose et provoque ... ... Dictionnaire encyclopédique
Article principal : Bâtonnets (rétine) La rhodopsine (un nom obsolète mais encore utilisé pourpre visuel) est le principal pigment visuel. Contenu dans les bâtons de la rétine de l'œil des invertébrés marins, des poissons, presque tous terrestres ... ... Wikipedia
25-10-2014, 13:04
Les quanta de lumière sont absorbés dans les récepteurs par des molécules spécialisées - les photopigments visuels. Les pigments visuels ont été découverts indépendamment par les physiologistes allemands F. Boll et W. Kuehne en 1877-1879. F. Boll a remarqué que la rétine isolée du verre visuel d'une grenouille semble d'abord rouge, puis, s'estompant à la lumière, devient jaune et, enfin, complètement incolore.
W. Kuehne a découvert que dans un œil d'animal fonctionnant normalement, la couleur de la rétine après un éclairage intense avec de la lumière est restaurée si l'animal est à nouveau placé dans l'obscurité. Sur la base de ces observations, il a été conclu qu'il existe une substance photosensible (pigment) dans la rétine de l'œil, dont la concentration diminue à la lumière et se rétablit dans l'obscurité.
pigments visuels sont des molécules complexes de chromolipoprotéines qui, chez les vertébrés et les invertébrés, se composent de deux parties principales : un chromophore (la partie colorante de la molécule qui détermine la couleur du récepteur lorsqu'il est illuminé) et une protéine (opsine). Le chromophore détermine le maximum et l'intensité de l'absorption de la lumière dans le pigment et est un aldéhyde d'alcools - vitamines A1 et A2.
Les noms de ces aldéhydes sont rétinal-1 et rétinal-2. La présence d'une double liaison supplémentaire dans le rétinal-2 conduit à un déplacement du maximum du spectre d'absorption vers la région des grandes longueurs d'onde. La rétine s'attache à l'opsine, une mutation protéique présente uniquement dans les photorécepteurs. L'opsine en bâtonnet, la scotopsine, et les cônes, la photopsine, sont isolés. La scotopsine est constituée de 230 à 270 résidus d'acides aminés, dont la séquence n'a pas encore été déterminée.
On sait peu de choses sur la photopsine : il n'y a que des données sur sa configuration hélicoïdale. La partie réelle absorbant la lumière de la molécule de pigment, la rétine, est un type de pigment caroténoïde, le plus courant dans la photosynthèse. tissus de plantes et d'animaux.
Les caractéristiques spectrales des pigments sont déterminées par des combinaisons de l'un des rétinaux avec l'une ou l'autre variété d'opsines, dont la diversité détermine la diversité des pigments visuels chez différents animaux. Ainsi, la combinaison de la scotopsine avec le rétinal-1 conduit à la formation d'un pigment en bâtonnet - la rhodopsine avec un maximum d'absorption à ? = 500 nm, et sa combinaison avec le rétinal-2 forme un autre pigment en bâtonnet - la porphyropsine avec un maximum d'absorption à ? = 525 nm. Combinaisons de rétinal-1 avec différentes sortes les photopsines dans la rétine des humains et des singes forment des pigments coniques avec des maxima d'absorption à? = 445 nm, ? = 535 nm et ? \u003d 570 nm, appelés respectivement cyanolab, chlorolab et erythrolab.
Les propriétés d'absorption de la lumière des pigments sont déterminées précisément par l'interaction du chromophore de l'iopsine : les maxima d'absorption du chromophore et de l'opsine, pris séparément, sont localisés dans la région ? \u003d 278 nm (rétinal-1) et ? = 378 nm (scotopsine), alors que leur composé - la rhodopsine - a un maximum d'absorption à ? = 500nm. Le maximum d'absorption est l'un des paramètres des caractéristiques spectrales du pigment, qui détermine, en général, l'efficacité d'absorption par le pigment de quanta de lumière (photons) de différentes longueurs d'onde (Fig. 3.1.4a).
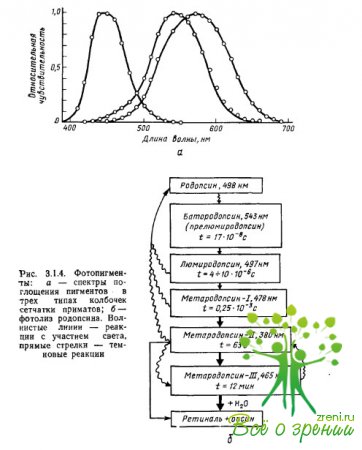
Les premières mesures des spectres d'absorption des pigments dans des cônes individuels de la rétine de singes et d'humains ont été réalisées par Brown, Wald et Marx et al., en utilisant une méthode de microspectrophotométrie spécialement développée à cet effet. La préparation rétinienne a été placée sous un microscope, ce qui a permis, sous contrôle visuel, de focaliser un faisceau lumineux de l'une ou l'autre longueur d'onde sur le segment externe du photorécepteur, qui contient le pigment.
Ensuite, pour chaque longueur d'onde, la quantité de lumière qui traversait le cône et n'était pas absorbée par celui-ci était mesurée séparément (la différence entre la quantité de lumière fournie au cône et la quantité de lumière transmise par celui-ci caractérisait l'efficacité d'absorption de photons d'une longueur d'onde donnée par le pigment). Les mesures ont été répétées après la décoloration des pigments à la suite d'un éclairage intense (mesures de référence). En soustrayant la deuxième série de mesures de la première, le spectre d'absorption différentiel du pigment a été obtenu en fonction de la sensibilité à la lumière sur la longueur d'onde du rayonnement.
De la fig. 3.1.4a, on peut voir que les pigments ont des spectres d'absorption à large bande, se chevauchant fortement. Tous les photopigments ont une caractéristique maximale d'absorption supplémentaire des caroténoïdes (appelée nis-pic" ou "?-pic"), égale aux 2/3 du maximum principal. Pour les pigments, dont les principaux maxima d'absorption sont localisés dans les parties du spectre à courte et moyenne longueur d'onde, le pic cis tombe dans la région ultraviolette et n'affecte pas l'analyse du rayonnement du spectre visible. Si, en outre, lors de la construction des fonctions de la sensibilité spectrale des pigments, l'échelle de longueur d'onde (axe des abscisses) est convertie en une échelle de fréquence, alors les spectres d'absorption de tous les pigments, y compris différentes opsines, mais le même retial (par exemple, rétinien -1), aura la même et la même forme.
Avec cette présentation de données, proposée pour la première fois par Dartnall "(1953) pour les pigments à base de rétinal-1, les spectres d'absorption de différents photopigments ne diffèrent que par la position du maximum. Et puis, connaissant le maximum d'absorption du pigment, nous pouvons restituer la forme de son spectre d'absorption, d'abord dans les coordonnées "fréquence de rayonnement - sensibilité", puis, en utilisant le rapport c = ?f et dans les coordonnées "longueur d'onde - sensibilité".
Cette méthode de restauration du spectre d'absorption d'un pigment inconnu à partir de données uniquement sur son maximum est appelée la méthode du nomogramme. La méthode des nomogrammes est également largement utilisée en neurophysiologie de la vision des couleurs pour résoudre le problème du nombre et du type de photodétecteurs convergeant vers tel ou tel neurone sensible à la couleur : la fonction de sensibilité spectrale d'un neurone est comparée à tel ou tel nomogramme ( ou leur combinaison).
La diversité des photopigments dans le règne animal est en corrélation avec la diversité des habitats environnementaux. Chez les poissons et les amphibiens, la rétine peut contenir à la fois de la rhodopsine et de la porphyropsine, dont le rapport change au cours de la vie de l'individu ; chez les poissons anadromes, le remplacement de la rhodopsine par la porphyropsine précède le passage de l'eau salée à l'eau douce et inversement. L'association de la composition des pigments avec l'écologie de l'habitat n'est pas rigide : les changements dans la composition des pigments peuvent être causés par les changements saisonniers et les rythmes circadiens.
Photoisomérisation.
La réaction d'un photopigment à la lumière est déterminée par le nombre de quanta absorbés, quelle que soit la longueur d'onde et l'énergie de rayonnement : par exemple, ceux absorbés par la rhodopsine. 10 quanta de lumière à ? \u003d 430 nm y provoquent les mêmes changements structurels (Fig. 3.1.46), ainsi que 10 quantums de lumière absorbés à? = 500nm.
Et la sélectivité spectrale (spectre d'absorption) du pigment n'est déterminée que par la probabilité différente d'absorption des quanta de lumière de différentes parties du spectre visible. Ainsi, les pigments visuels, et finalement les photorécepteurs, fonctionnent comme des "compteurs de photons de lumière", ne différant les uns des autres que par la probabilité d'absorber des photons de différentes longueurs d'onde.
Lorsqu'une molécule de rhodopsine absorbe 1 quantum de lumière, un changement dans la configuration spatiale d'une molécule de rétinal se produit - la photoisomérisation, qui consiste en la transformation de la forme de 11 cm de rétinal en une transformation complète (Fig. 3.1.4b) .

La photoisomérisation s'accompagne d'un cycle de réactions photochimiques, pour le décodage duquel G. Wald a reçu le prix Nobel en 1930. Les produits finaux de la photoisomérisation sont entièrement du traxrétinal et de l'opsine. Toutes les réactions intermédiaires jusqu'à l'étape métarhodopsine-II sont réversibles : les produits de ces réactions peuvent être reconvertis en rhodopsine par isomérisation inverse de la gran-rétine.
Cela signifie qu'aucun changement conformationnel significatif ne se produit dans la molécule de pigment avant la métarhodopsine-II. Au stade de la métarhodopsine-II, le rétinal est détaché de la partie protéique de la molécule. De toutes les étapes de l'isomérisation, seule la première - la transformation de la rhodopsine en prélumirhodopsine (bathorhodopsine) - a besoin de lumière. Toutes les autres réactions se déroulent dans l'obscurité. La photoisomérisation se déroule de manière similaire dans les pigments coniques.
Ainsi, la photoisomérisation est un mécanisme moléculaire déclencheur (démarrage) de la photoréception, qui consiste à modifier la configuration spatiale de la molécule de pigment visuel. Ce dernier explique pourquoi la nature a choisi les caroténoïdes comme pigment visuel : la présence de doubles liaisons dans le rétinal détermine la possibilité de son isomérisation et ; sa grande réactivité. Autour de chaque double liaison, des parties de la molécule peuvent tourner et se plier dans l'espace. Cette forme est la moins stable et la plus sensible à la température et à la lumière. Trouvé dans la nature différentes sortes rétinien - formes 7, 9, 11, 13-cis, forme 9.13-dicis, mais dans les pigments visuels, le rétinal est toujours sous forme 11-cis.
La resynthèse pigmentaire dans les photorécepteurs se produit en continu à la lumière et dans l'obscurité avec la participation de l'enzyme rétinène isomérase et consiste en l'isomérisation inverse du rétinol de la forme transformée à la forme 11-cis. Dans les cônes, cette enzyme est localisée dans les récepteurs eux-mêmes, dans les bâtonnets, dans l'épithélium pigmentaire, où le trans-rétinol passe après détachement de l'opsine et où il est isomérisé sous la forme 11-cis. Dans ce cas, la vitamine A rétinienne est réutilisée et la protéine est synthétisée dans les ribosomes du segment interne.
On suppose que la recombinaison du 11-cis-rétinal avec l'opsine se produit spontanément. L'épithélium pigmentaire contient environ 11% de vitamine A (rétinol) sur 13% dans l'œil entier. La vitamine A se forme dans le foie en cassant la chaîne du caroténoïde contenu dans les aliments en deux parties et en ajoutant de l'eau.
La vitamine A est transportée par une protéine spéciale de liaison au rétinol vers l'épithélium pigmentaire, où elle est oxydée en rétinal. Avec une carence en vitamine A, la soi-disant «cécité nocturne» se produit - une diminution de la sensibilité absolue à la lumière, qui affecte particulièrement la vision au crépuscule, se transformant en cécité permanente en raison de la destruction d'une protéine instable à l'état libre. Par conséquent, avec une maladie de "cécité nocturne", il est recommandé de manger des carottes contenant de la provitamine A - bêta-carotène.
Chaque photorécepteur ne contient qu'un seul photopigment, caractérisé par l'un ou l'autre spectre d'absorption. À cet égard, des cônes de courte, moyenne et longue longueur d'onde sont isolés, contenant des pigments chez les primates avec des maxima d'absorption, respectivement, à 445 nm, 535 nm et 570 nm. À poisson d'eau douce le cône de grande longueur d'onde contient un pigment avec un maximum d'absorption à 620 nm, qui est en corrélation avec la forme de la distribution spectrale de la lumière dans leur habitat.
Ces cônes sont parfois appelés récepteurs sensibles au bleu, au vert et au rouge, suivant une tradition remontant à l'hypothèse de Young-Helmholtz à trois composants. Mais depuis la seconde moitié du 20e siècle, lorsqu'il a été constaté qu'aucun photorécepteur n'effectue à lui seul une analyse spectrale, mais ne réagit qu'au nombre de photons absorbés, quelle que soit la longueur d'onde du rayonnement, ces noms de couleur des récepteurs ne sont utilisés que dans un sens métaphorique. sens.
La classification des bâtonnets, par exemple, chez une grenouille, en "vert" et "rouge" dans certains cas n'est pas basée sur la sensibilité spectrale du pigment qu'ils contiennent, mais sur la couleur des corps récepteurs en lumière transmise. Ainsi, les bâtonnets "verts" contiennent un pigment avec un maximum d'absorption à 432 nm. Par conséquent, lorsqu'ils sont éclairés par une lumière blanche, ils absorbent le rayonnement à ondes courtes, passant toutes les autres longueurs d'onde, et ont un aspect verdâtre lorsqu'ils sont contrôlés visuellement.
Dans la rétine des poissons, une relation a été notée entre la longueur du cône et le type spectral du pigment qu'il contient : les plus courts d'entre eux contiennent un pigment à ondes courtes, et les plus longs contiennent un pigment à ondes longues. Eberle a suggéré que cela pourrait être l'un des mécanismes pour traiter l'aberration chromatique. En raison de l'aberration chromatique, l'image nette du rayonnement à ondes moyennes est située plus profondément (plus loin de l'objectif) que l'image nette du rayonnement à ondes courtes, et le foyer du rayonnement à ondes longues est situé encore plus loin.
Il suffit de disposer les récepteurs à courte, moyenne et longue longueur d'onde aux niveaux appropriés pour que toutes les parties du rayonnement spectral soient focalisées de manière égale sur les récepteurs. Cela explique peut-être le fait que dans la rétine des poissons, les cônes simples à segments courts contiennent un pigment à courte longueur d'onde, tandis que dans un double cône, le segment le plus long contient un pigment à longue longueur d'onde, et le plus court contient un pigment à courte longueur d'onde. ou pigment de longueur d'onde moyenne. Les cônes doubles avec des segments de longueur égale contiennent le même pigment.
ωπς - œil) - Nom commun plusieurs pigments visuels de l'homme et de certains mammifères. Ces pigments sont composés d'une molécule protéique associée au chromophore rétinien. Contenue dans les cônes de la rétine de l'œil et fournit une vision des couleurs, contrairement à un autre pigment visuel - la rhodopsine, responsable de la vision crépusculaire.Il a été établi que la composition des pigments visuels comprend des opsines. Différentes opsines diffèrent dans leur composition en acides aminés et absorbent la lumière à des longueurs d'onde légèrement différentes comme les molécules liées à la rétine.
L'existence d'un pigment de cône a été découverte (indirectement) pour la première fois par George Wald, qui lui a donné son nom. iodopsine. . En 1967, il a reçu le prix Nobel de physiologie ou médecine pour ces travaux.
Même Helmholtz croyait que dans "l'appareil terminal des fibres du nerf optique" (photorécepteurs de la rétine), il devrait y avoir trois types de substances photochimiquement décomposées qui ont une sensibilité différente par rapport à Différents composants spectre. .
Selon la théorie de la vision à trois composants qui prévaut dans la science moderne, on pense qu'il existe trois types de ce pigment et que la rétine contient respectivement trois types de cônes sensibles à la lumière bleue, verte et rouge. En conséquence, l'iodopsine, située dans les cônes de l'œil, se compose de trois pigments - chlorolab, erythrolab et cyanolab ; le premier d'entre eux absorbe les rayons correspondant au jaune-vert (bande d'absorption 450-630 nm), le deuxième - jaune-rouge (500-700 nm) et le troisième - bleu-vert (500-700 nm) partie du visible spectre.
Types de pigments visuels
Les premières tentatives pour trouver trois pigments et, comme prévu, trois types de cônes (sur la base des hypothèses de l'hypothèse de la vision à trois composants selon laquelle chaque cône ne contient qu'un seul pigment) ont été menées par Rushton, qui a perfectionné la technique de densitométrie pour in vivo mesure des coefficients d'absorption de la lumière avec différentes longueurs d'onde - dans la couche photorécepteurs rétiniens. Il a été démontré que les anomalies de couleur manquent de l'un des pigments présents chez les personnes ayant une vision normale : "erythrolab" (maximum d'environ 585 nm.) dans le protanop et "chlorolab" (maximum d'environ 540 nm.) dans le deutéranop.
Il convient de noter que lors de l'utilisation du terme "récepteur", dans certains cas, l'ensemble des photorécepteurs avec la même sensibilité spectrale est considéré comme un seul receveur; dans d'autres cas, la question est de savoir si chaque cône fovéal contient trois receveur ou juste un. Dans le même temps, la rigueur du concept de "récepteur" n'est pas violée, qui dans ce cas n'inclut pas de caractéristiques morphologiques spécifiques.
L'étape suivante dans cette direction a été l'étude des photopigments contenus dans les cônes humains et macaques individuels. Les tailles des cônes fovéaux sont trop petites pour faire l'objet d'étude, et toutes les données obtenues ne concernent que les cônes parafovéaux. Chaque cône, du moins celui extrafovéolaire, semble contenir un seul des pigments, ou majoritairement l'un d'entre eux.
Méthodes modernes d'étude des photopigments de cône
Densitométrie cellulaire rétinienne
→ densitométrie, peut être la suivante :
Si les premières tentatives pour trouver trois pigments et, comme prévu, trois types de cônes ont été réalisées par Rushton, qui a perfectionné la technique Densitométrie mesurer les coefficients d'absorption de la lumière avec différentes longueurs d'onde - dans la couche de photorécepteurs rétiniens et il a été démontré que les anomalies de couleur manquent de l'un des pigments que les personnes ayant une vision normale ont: "erythrolab" (maximum environ 585 nm.) dans protanop et " chlorolab" ( maximum environ 540 nm.) - dans le deutéranop, maintenant à l'aide de méthodes spéciales de dystométrie utilisant des densitomètres modernes, les scientifiques parviennent à déterminer le travail des cônes et des bâtonnets dans un état d'activité normale et à diagnostiquer leurs maladies.
voir également
Sources
Littérature
- Khokhlova T.V. Idées modernes sur la vision des mammifères // Journal of General Biology. Volume 73, 2012. N° 6, novembre-décembre. Page 418-434.



