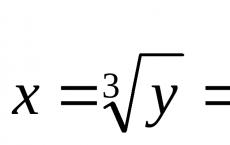A hőmérséklet-változás befolyásolja a pH-értéket? Az enzimatikus reakció sebességének függése a hőmérséklettől, a pH-tól és az inkubációs időtől
Állami támogatási rendszer
a mérések egysége
STANDARD CÍMEK A FŐZÉSRE
PUFFER MEGOLDÁSOK -
MŰKÖDÉSI SZABVÁNYOK pH 2 és 3. DIAGRAM
Műszaki és metrológiai jellemzők
Meghatározásuk módszerei
|
Moszkva |
Előszó
Az államközi szabványosítási munkák céljait, alapelveit és alapvető eljárásait a GOST 1.0-92 „Államközi szabványosítási rendszer. Alapvető rendelkezések" és a GOST 1.2-97 "Államközi szabványosítási rendszer. Államközi szabványok, szabályok és ajánlások az államközi szabványosításhoz. A fejlesztés, az elfogadás, a kérelem, a frissítés és a törlés eljárása"
Normál információ
1 A Szövetségi Műszaki Szabályozási és Metrológiai Ügynökség "Összororoszországi Fizikai-műszaki és rádiótechnikai mérések tudományos kutatóintézete" (FSUE "VNIIFTRI") FEJLESZTÉSE
2 A Szövetségi Műszaki Szabályozási és Metrológiai Ügynökség BEVEZETE
3 ELFOGADTA az Államközi Szabványügyi, Mérésügyi és Tanúsítási Tanács (2004. december 8-i 26. sz. jegyzőkönyv)
|
Az ország rövid neve az MK (ISO 3166) 004-97 szerint |
Országkód az MK (ISO 3166) 004-97 szerint |
A nemzeti szabványügyi testület rövidített neve |
|
Azerbajdzsán |
Azstandard |
|
|
Fehéroroszország |
A Fehérorosz Köztársaság állami szabványa |
|
|
Kazahsztán |
A Kazah Köztársaság állami szabványa |
|
|
Kirgizisztán |
Kirgiz szabvány |
|
|
Moldova |
Moldova-szabvány |
|
|
Orosz Föderáció |
Szövetségi Műszaki Szabályozási és Metrológiai Ügynökség |
|
|
Tádzsikisztán |
Tádzsik szabvány |
|
|
Üzbegisztán |
Uzstandard |
4 A Szövetségi Műszaki Szabályozási és Mérésügyi Ügynökség 2005. április 15-i, 84. sz. rendeletével a GOST 8.135-2004 államközi szabványt nemzeti szabványként közvetlenül hatályba léptették. Orosz Föderáció 2005. augusztus 1. óta
6 KÖZTÁRSASÁG. 2007. december
A jelen szabvány hatálybalépésére (megszűnésére) és módosításaira vonatkozó információk a „Nemzeti Szabványok” indexben kerülnek közzétételre.
A szabvány változásaira vonatkozó információk a „Nemzeti Szabványok” indexben (katalógus), a változtatások szövege pedig a tájékoztató táblák „Nemzeti Szabványok”. A szabvány felülvizsgálata vagy visszavonása esetén a vonatkozó információkat a „Nemzeti szabványok” információs indexben teszik közzé.
ÁLLAMKÖZI SZABVÁNY
Bevezetés dátuma - 2005-08-01
1 felhasználási terület
Ez a szabvány a standard titerekre vonatkozik, amelyek a vegyszerek fiolákban vagy ampullákban történő pontos mérése, és amelyeket bizonyos pH-értékű pufferoldatok készítésére szánnak, és meghatározza ezek meghatározására szolgáló műszaki és metrológiai jellemzőket és módszereket.
2 Normatív hivatkozások
Ez a szabvány a következő szabványokra vonatkozó normatív hivatkozásokat használ:
3.4 A standard titereket a 0,25; 0,50 és 1 dm 3 pufferoldat. Az 1 dm 3 pufferoldat elkészítéséhez szükséges anyagminta névleges tömegét a táblázat tartalmazza.
Asztal 1
|
A standard titerben szereplő vegyszerek |
Anyagminta névleges tömege m nom a standard titerben, 1 dm 3 pufferoldat készítéséhez 1, g |
A pufferoldat névleges pH-értéke 25 °C-on 2) |
|
|
× 2H 2O |
25,219 |
1,48 |
|
|
Kálium-tetraoxalát 2-víz KH 3 (C 2 O 4) 2× 2H 2O |
12,610 |
1,65 |
|
|
Nátrium-hidrodiglikolát C 4 H 5 O 5 Na |
7,868 |
3,49 |
|
|
Kálium-hidrogén-tartarát KNS 4 H 4 C 6 |
9,5 3) |
3,56 |
|
|
Kálium-hidroftalát KNS 8 H 4 O 4 |
10,120 |
4,01 |
|
|
Ecetsav CH 3 COOH Nátrium-acetát CH 3 COONa |
6,010 8,000 |
4,64 |
|
|
Ecetsav CH 3 COOH Nátrium-acetát CH 3 COONa |
0,600 0,820 |
4,71 |
|
|
Piperazin-foszfát C 4 H 10 N 2 H 3 PO 4 |
4,027 |
6,26 |
|
|
Nátrium-monohidrogén-foszfát Na2HPO4 |
3,3880 3,5330 |
6,86 |
|
|
Kálium-dihidrogén-foszfát KH 2 PO 4 Nátrium-monohidrogén-foszfát Na2HPO4 |
1,1790 4,3030 |
7,41 |
|
|
Kálium-dihidrogén-foszfát KH 2 PO 4 Nátrium-monohidrogén-foszfát Na2HPO4 |
1,3560 5,6564 |
7,43 |
|
|
Trisz 4) (HOCH 2) 3 CNH 2 Trisz 4) hidroklorid (HOCH 2) 3 CNH2HCl |
2,019 7,350 |
7,65 |
|
|
Nátrium-tetraborát 10-víz Na 2B 4 O 7 × 10H 2 O |
3,8064 |
9,18 |
|
|
Nátrium-tetraborát 10-víz Na 2B 4 O 7 × 10H 2 O |
19,012 |
9,18 |
|
|
Nátrium-karbonát Na2CO3 Nátrium-karbonát sav NaHCO3 |
2,6428 2,0947 |
10,00 |
|
|
Kalcium-hidroxid Ca(OH) 2 |
1,75 3) |
12,43 |
|
|
1) 0,50 és 0,25 dm 3 térfogatú pufferoldat készítéséhez az anyagminta tömegét 2-szeresére, illetve 4-szeresére kell csökkenteni. 2) A pufferoldatok pH-értékének hőmérséklettől való függését a Függelék tartalmazza . 3) Egy minta telített oldat készítéséhez. 4) Trisz-(hidroxi-metil)-amino-metán. |
|||
3.5 A mért anyagok standard titerben mért tömegének meg kell felelnie a névleges értékeknek, legfeljebb 0,2% megengedett eltéréssel. A kálium-hidrogén-tartarát és kalcium-hidroxid telített oldatainak elkészítéséhez standard titerekben mért tömegeknek meg kell felelniük a névleges értékeknek, legfeljebb 1%-os megengedett eltéréssel.
3.6 A standard titerekből készített pufferoldatoknak meg kell felelniük a táblázatban megadott névleges pH-értékeknek.
A névleges pH-értéktől való megengedett eltérés nem haladhatja meg a következő határértékeket:
± 0,01 pH - pufferoldatok esetén - 2. kategória működési pH-standardja;
± 0,03 pH - pufferoldatokhoz - 3. kategória üzemi pH szabványok.
3.7 A standard titerek előállíthatók vegyi anyagok kimért porainak és vizes oldatainak formájában (standard titerek ecetsavval - csak vizes oldatok formájában), hermetikusan lezárt palackokba csomagolva vagy üvegbe zárva ampullák.
A vizes oldatok készítéséhez desztillált vizet használnak a GOST 6709 szerint.
3.8 A szabványos titerek csomagolására, csomagolására, címkézésére és szállítására vonatkozó követelmények - az egyes szabványos titerekre vonatkozó előírások szerint.
3.9 A szabványos címek működési dokumentációjának a következő információkat kell tartalmaznia:
Cél: a munka pH-standardok kategóriája (2. vagy 3.) - standard titerekből előállított pufferoldatok;
Pufferoldatok névleges pH-értéke 25 °С-on;
Pufferoldatok térfogata köbdeciméterben;
Módszertan (utasítás) pufferoldatok standard titerekből történő előállítására, a szabvány függelékével összhangban kidolgozott;
Szabványos eltarthatósági titer.
4 Módszerek standard titerek jellemzésére
4.1 A minták számanaz egyes módosítások jellemzőinek meghatározásához standard titereket választunk ki aszerint GOST 3885 e módosítás standard titereinek tételének térfogatától függően, de legalább három standard titer minta ampullákban (pH meghatározásához) és legalább hat minta fiolában (3 - tömegmeghatározáshoz, 3 - pH-meghatározáshoz).
4.2 Az alkalmazott mérőeszközöknek érvényes hitelesítési idővel rendelkező hitelesítési tanúsítványokkal (tanúsítványokkal) kell rendelkezniük.
4.3 A méréseket normál körülmények között kell elvégezni:
környezeti levegő hőmérséklete, °С 20 ± 5;
a levegő relatív páratartalma, % 30 és 80 között;
légköri nyomás, kPa (Hgmm) 84-106 (630-795).
4.4 Az 1) fiolában lévő vegyszer lemért tömegét a lemért injekciós üveg és az üres tiszta fiola tömegének különbsége határozza meg. A minta tömegének és az injekciós üveg tömegének mérését legfeljebb 0,0005 g hibával kell elvégezni analitikai mérlegen (pontossági osztály nem alacsonyabb, mint 2 a GOST 24104 szerint).
1) Egy üvegampullában a standard titerű minta tömege nincs meghatározva.
4.4.1 D eltérés én, %, a minta tömegét az egyes minták tömegének névleges értékéből a képlet határozza meg
|
|
Ahol m nom- a standard titer részét képező vegyi anyag mintájának névleges tömege (lásd a táblázatot);
én
m i- tömegmérés eredményeén-edik minta ( én = 1 ... n), G.
4.4.2 Ha legalább az egyik mintánál az érték D éntöbb mint 0,2% lesz (és a telített pufferoldatok készítéséhez használt standard titereknél - több mint 1%), akkor ennek a módosításnak a standard titereinek tétele el lesz utasítva.
4.5.1 A pufferoldat pH-értéke - a standard titerből előállított 2. kategóriás munkastandard pH-t az 1. kategóriás munkastandard pH-val (GOST 8.120) határozzuk meg a pufferoldatok hőmérsékletén (25). ± 0,5) °C-on, a pH-mérési eljárásoknak megfelelően előírások 1. kategória üzemi pH-szabványa.
4.5.1.1 A pH eltérése a névleges értéktől ( D pH) énképlet határozza meg
|
(DpH) én= | pH nom - pH i | , |
Ahol én- standard titer mintaszám;
pH nom - a pufferoldat névleges pH-értéke a táblázat szerint;
pH i - pH érték mérési eredményén minta ( én = 1 ... n).
4.5.1.2 Ha az érték ( D pH) énaz egyes pufferoldatok pH-ja nem haladja meg a 0,01-et, akkor ennek a sarzsnak a standard titerei alkalmasnak tekinthetők a 2. kategóriás munka pH-standard elkészítésére.
Ha az érték (D pH) énaz egyes pufferoldatok pH-ja nem haladja meg a 0,03-at, akkor ennek a sarzsnak a standard titerei alkalmasnak tekinthetők a 3. kategóriájú munka pH-standard elkészítésére.
(DpH) én
4.5.4 A pufferoldat pH-értékét - a standard titerből előállított 3. kategória munka-pH-értékét a 2. kategóriás standard pH-mérő (GOST 8.120) határozza meg a pH használati utasítása szerint. méter a pufferoldatok hőmérsékletén (25 ± 0,5) °C.
4.5.2.1 A pH eltérése a névleges értéktől ( D pH) én határozza meg .
4.5.2.2 Ha az érték ( D pH) énaz egyes pufferoldatok pH-ja nem haladja meg a 0,03-at, akkor ennek a sarzsnak a standard titerei alkalmasnak tekinthetők a 3. kategóriájú munka pH-standard elkészítésére.
Ha legalább az egyik pufferoldathoz(DpH) én0,03 pH-nál nagyobb lesz, akkor a méréseket kétszer annyi mintán megismételjük.
Az ismételt mérések eredménye végleges. Ha az eredmények negatívak, a standard titerek kötegét elutasítjuk.
A. melléklet
(kívánt)
A standard titerekhez szükséges vegyszereket legalább analitikai minőségű kémiai reagensek további tisztításával nyerik. A különleges tisztaságú és kémiai minőségű kémiai reagensek további tisztítás nélkül használhatók. A standard titerekre való alkalmasság végső kritériuma azonban a standard titerekből készített pufferoldatok pH-értéke. Az anyagok tisztításához desztillált víz (a továbbiakban: víz) használata szükséges, amelynek fajlagos elektromos vezetőképessége legfeljebb 5× 10 -4 cm × m -1 20 °C hőmérsékleten a GOST 6709 szerint.
A.1 Kálium-tetraoxalát 2-víz KH 3 (C 2 O 4) 2× A 2H 2 O-t vizes oldatokból 50 °C hőmérsékleten kétszeres átkristályosítással tisztítják. Szárítás természetes szellőzésű szárítószekrényben (55± 5) °C tömegállandóságig.
A.2 Nátrium-hidrodiglikolát (oxidiacetát) C 4 H 5 O 5 Na 110 °C hőmérsékleten tömegállandóságig szárítjuk. Ha a kémiai reagens nem áll rendelkezésre, akkor a nátrium-hidrodiglikolátot úgy állítják elő, hogy a megfelelő savat nátrium-hidroxiddal félig semlegesítik. Kristályosodás után a kristályokat porózus üvegszűrőn leszűrjük.
A.3 Kálium-hidrogén-tartarát (kálium-tartarát) A KNS 4 H 4 O 6-ot vizes oldatokból kétszeres átkristályosítással tisztítják; kemencében szárítjuk 110 °C hőmérsékleten± 5) °C tömegállandóságig.
A.4 Kálium-hidroftalát (kálium-ftalátsav) A KNS 8 H 4 O 4-et forró vizes oldatokból kétszeres átkristályosítással tisztítják kálium-karbonát hozzáadásával az első átkristályosítás során. A kivált kristályokat 36 °C-nál nem alacsonyabb hőmérsékleten szűrjük le. Szárítás természetes szellőzésű szárítószekrényben (110± 5) °C tömegállandóságig.
A.5 Az ecetsav CH 3 COOH (GOST 18270) tisztítása a következő módszerek egyikével történik:
a) desztilláció kis mennyiségű vízmentes nátrium-acetát hozzáadásával;
b) kettős frakcionált fagyasztás (a kristályosítási folyamat befejezése után a felesleges folyadékfázis eltávolítása).
A.6 Nátrium-acetát 3-víz (nátrium-acetát) CH 3 COONa × A 3H 2 O-t (GOST 199) forró vizes oldatokból kétszeres átkristályosítással tisztítják, majd a sót kalcinálják 120 °C-on.± 3) °C tömegállandóságig.
A.7 Piperazin-foszfát C 4 H 10 N 2 H 3 PO 4 × A H 2 O-t piperazinból és ortofoszforsavból (GOST 6552) szintetizálják, amelyet alkoholos oldatokból háromszoros átkristályosítással tisztítanak. Szárítsuk szilikagélen, sötétben exszikkátorban tömegállandóságig.
A.8 Az egyszeresen szubsztituált kálium-foszfát (kálium-dihidrogén-foszfát) KN 2 PO 4 (GOST 4198) kétszeres átkristályosítással tisztítják víz-etanol keverékből 1:1 térfogatarányban, majd szárítás kemencében hőmérsékleten ( 110± 5) °C tömegállandóságig.
A.9 Nátrium-foszfáttal diszubsztituált 12-víz (nátrium-monohidrogén-foszfát) Na2HPO4 (vízmentes) 12-hidrát sóból nyerik Na2HPO 4 × 12H 2 O (GOST 4172) háromszoros átkristályosítással forró vizes oldatokból. Szárítás (dehidratálás) természetes szellőztetésű szárítószekrényben szakaszosan a következő módokban:
A (30 ± 5) °C - tömegállandóságig
(50 ± 5) °С-on - » » »
(120 ± 5)°С - » » »
A.10 Trisz-(hidroxi-metil)-amino-metán ( HOCH 2 ) 3 CNH 2 80 °C-on kemencében tömegállandóságig szárítjuk.
A.11 Trisz-(hidroxi-metil)-amino-metán-hidroklorid ( HOCH 2 ) 3 CNH 2 HCl 40 °C-on kemencében tömegállandóságig szárítjuk.
A.12 Nátrium-tetraborát 10-víz Na 2 B 4 O 7 × A 10H 2 O-t (GOST 4199) háromszoros átkristályosítással tisztítják vizes oldatokból (50 °C hőmérsékleten).± 5) °C. Szobahőmérsékleten két-három napig szárítjuk. A nátrium-tetraborát végső előállítását úgy végezzük, hogy a sót üveggrafit (kvarc, platina vagy fluoroplasztikus) edényben exszikkátorban tartjuk nátrium-klorid és szacharóz telített oldata vagy telített oldat fölött. KBr szobahőmérsékleten tömegállandóságig.
A.13 Nátrium-karbonát Na 2CO3 (GOST 83) vizes oldatokból háromszoros átkristályosítással tisztítják, majd szárítószekrényben szárítják 275 °C hőmérsékleten.± 5) °C tömegállandóságig.
A.14 Nátrium-karbonát sav NaHCO3 (GOST 4201) háromszoros átkristályosítással tisztítják vizes oldatokból szén-dioxid buborékoltatásával.
A.15 A kalcium-hidroxidot Ca(OH) 2 kalcium-karbonát CaCO 3 (GOST 4530) (1000 °C hőmérsékleten) kalcinálásával állítják elő.± 10) °C-on 1 órán át.A kapott kalcium-oxid CaO-t levegőn szobahőmérsékletre lehűtjük, és lassan, kis részletekben állandó keverés közben vízzel felöntjük, amíg szuszpenziót nem kapunk. A szuszpenziót forrásig melegítjük, lehűtjük és üvegszűrőn átszűrjük, majd kivesszük a szűrőből, vákuum-exszikkátorban tömegállandóságig szárítjuk, majd finom porrá őröljük. Exszikkátorban tárolandó.
B. függelék
(tájékoztató)
|
Szabványos címmódosítási szám |
A standard titerben szereplő vegyi anyagok (módosítások a táblázat szerint) |
Pufferoldatok pH-ja hőmérsékleten, °C |
|||||||||||||
|
Kálium-tetraoxalát 2-víz |
1,48 |
1,48 |
1,48 |
1,49 |
1,49 |
1,50 |
1,51 |
1,52 |
1,53 |
1,53 |
|||||
|
Kálium-tetraoxalát 2-víz |
1,64 |
1,64 |
1,64 |
1,65 |
1,65 |
1,65 |
1,65 |
1,65 |
1,66 |
1,67 |
1,69 |
1,72 |
|||
|
Nátrium-hidrodiglikolát |
3,47 |
3,47 |
3,48 |
3,48 |
3,49 |
3,50 |
3,52 |
3,53 |
3,56 |
3,60 |
|||||
|
Kálium-hidrogén-tartarát |
3,56 |
3,55 |
3,54 |
3,54 |
3,54 |
3,55 |
3,57 |
3,60 |
3,63 |
||||||
|
Kálium-hidroftalát |
4,00 |
4,00 |
4,00 |
4,00 |
4,00 |
4,01 |
4,01 |
4,02 |
4,03 |
4,05 |
4,08 |
4,12 |
4,16 |
4,21 |
|
|
4,66 |
4,66 |
4,65 |
4,65 |
4,65 |
4,64 |
4,64 |
4,65 |
4,65 |
4,66 |
4,68 |
4,71 |
4,75 |
4,80 |
||
|
Ecetsav + nátrium-acetát |
4,73 |
4,72 |
4,72 |
4,71 |
4,71 |
4,71 |
4,72 |
4,72 |
4,73 |
4,74 |
4,77 |
4,80 |
4,84 |
4,88 |
|
|
Piperazin-foszfát |
6,48 |
6,42 |
6,36 |
6,31 |
6,26 |
6,21 |
6,14 |
6,12 |
6,03 |
5,95 |
|||||
|
6,96 |
6,94 |
6,91 |
6,89 |
6,87 |
6,86 |
6,84 |
6,83 |
6,82 |
6,81 |
6,82 |
6,83 |
6,85 |
6,90 |
||
|
Nátrium-monohidrogén-foszfát + kálium-dihidrogén-foszfát |
7,51 |
7,48 |
7,46 |
7,44 |
7,42 |
7,41 |
7,39 |
7,37 |
|||||||
|
Nátrium-monohidrogén-foszfát + kálium-dihidrogén-foszfát |
7,51 |
7,49 |
7,47 |
7,45 |
7,43 |
7,41 |
7,40 |
||||||||
|
Trisz-hidroklorid + trisz |
8,40 |
8,24 |
8,08 |
7,93 |
7,79 |
7,65 |
7,51 |
7,33 |
7,26 |
7,02 |
6,79 |
||||
|
Nátrium-tetraborát |
9,48 |
9,41 |
9,35 |
9,29 |
9,23 |
9,18 |
9,13 |
9,07 |
9,05 |
8,98 |
8,93 |
8,90 |
8,88 |
8,84 |
|
|
Nátrium-tetraborát |
9,45 |
9,39 |
9,33 |
9,28 |
9,23 |
9,18 |
9,14 |
9,09 |
9,07 |
9,01 |
8,97 |
8,93 |
9,91 |
8,90 |
|
|
Nátrium-karbonát sav + nátrium-karbonát |
10,27 |
10,21 |
10,15 |
10,10 |
10,05 |
10,00 |
9,95 |
9,89 |
9,87 |
9,80 |
9,75 |
9,73 |
9,73 |
9,75 |
|
|
Kálcium hidroxid |
13,36 |
13,16 |
12,97 |
12,78 |
12,60 |
jegyzet - 6-nál nagyobb pH-értékű oldatok készítéséhez a desztillált vizet fel kell forralni, és 25-30 °C-ra kell hűteni. Az üvegedények elkészítésekor nem szabad szintetikus mosószert használni. B.1.1 A titerstandardot a GOST 1770 szerinti 2. osztályú mérőlombikba (a továbbiakban: lombik) visszük át. B.1.2 Vegye ki az üveget (ampullát) a csomagolásból. B.1.3 Mossa le vízzel az üveg (ampulla) felületét és szárítsa meg szűrőpapírral. B.1.4 Helyezzen egy tölcsért a lombikba, nyissa ki az üveget (ampullát) a gyártó utasításai szerint, hagyja, hogy a tartalom teljesen a lombikba öntsön, öblítse le a palackot (ampullát) belülről vízzel, amíg az anyag teljesen el nem távolodik a felületekről öntse a mosóvizet a lombikba. B.1.5. Töltse fel a lombikot vízzel körülbelül a térfogat kétharmadáig, rázzuk addig, amíg a tartalom teljesen fel nem oldódik (a kálium-hidrogén-tartarát és kalcium-hidroxid telített oldatai kivételével). B.1.6 Töltse fel a lombikot vízzel anélkül, hogy vizet adna hozzá az 5-10 cm 3 -es jelig. A lombikot 30 percig 20 °C-os víztermosztátban termosztáljuk (a kálium-hidrogén-tartarát és kalcium-hidroxid telített oldatát tartalmazó lombikokat teljesen megtöltjük vízzel, és legalább 4 órán át 25 °C hőmérsékleten termosztáljuk, és 20 °C-on, a lombikban lévő szuszpenziót rázással rendszeres időközönként megkeverve). B.1.7. Töltse fel a lombikban lévő oldat térfogatát vízzel a jelig, zárja le dugóval, és alaposan keverje össze a tartalmát. A kálium-hidrogén-tartarát és kalcium-hidroxid telített oldataiból vett mintákban a csapadékot szűréssel vagy dekantálással távolítják el. AT 2 Működő pH-standardok tárolása B.2.1 A működő pH-standardokat szorosan lezárt üveg vagy műanyag (polietilén) tartályokban, sötét helyen, 25 °C-ot meg nem haladó hőmérsékleten kell tárolni. A munkastandardok eltarthatósága az elkészítéstől számított 1 hónap, kivéve a kálium-hidrogén-tartarát és kalcium-hidroxid telített oldatait, amelyeket közvetlenül a pH mérése előtt készítenek, és amelyek nem tárolhatók. | |||||||||
A potenciometria az egyik elektrokémiai elemzési módszer, amely az elektrolitok koncentrációjának meghatározásán alapul, a vizsgálati oldatba merített elektróda potenciáljának mérésével.
Potenciál (a lat. potencia– erő) a fizikai erőtereket (elektromos, mágneses, gravitációs) és általában a vektorfizikai mennyiségek mezőit jellemzi.
Az oldatban lévő ionok koncentrációjának potenciometriás mérésének módszere a vizsgálati oldatba helyezett két speciális elektróda elektromos potenciálkülönbségének mérésén alapul, és az egyik elektród - a segédelektród - állandó potenciállal rendelkezik a mérési folyamat során.
Lehetséges E külön elektródát határoznak meg a Nernst-egyenlet segítségével (W. Nernst – német fizikai kémikus, 1869–1941) standard (normál) potenciálján keresztül E 0 és ionaktivitás A+ , amelyek részt vesznek az elektróda folyamatában
E = E 0 + 2,3 lg a + , (4.1)
Ahol E 0 – a határfelületi potenciálkülönbség összetevője, amelyet az elektróda tulajdonságai határoznak meg, és nem függ az oldatban lévő ionok koncentrációjától; R– univerzális gázállandó; n– ion vegyérték; T - abszolút hőmérséklet; F – Faraday-szám (M. Faraday – 19. századi angol fizikus).
Az elektrokémiai rendszerek egy szűk osztályára, egy fémre – ugyanazon fém kationjainak oldatára – levezetett Nernst-egyenlet sokkal szélesebb tartományban érvényes.
A hidrogénionok aktivitásának meghatározására legszélesebb körben a potenciometrikus módszert alkalmazzák, amely az oldat savas vagy lúgos tulajdonságait jellemzi.
A hidrogénionok oldatban való megjelenését a disszociáció okozza (a lat. disszociáció- a vízmolekulák egy részének elválasztása, hidrogén- és hidroxil-ionokra bomlás:
H 2
O↔ +
+
 .
(4.2)
.
(4.2)
A tömeghatás törvénye szerint az állandó NAK NEK a víz disszociációs reakciójának egyensúlya egyenlő K=
 .
.  /
/
 .
.
A nem disszociált molekulák koncentrációja a vízben olyan magas (55,5 M), hogy állandónak tekinthető, ezért az (5.2) egyenletet leegyszerűsítjük:  = 55,5 =
= 55,5 =
 .
.  , Ahol
, Ahol  - a víz ionos termékének nevezett állandó,
- a víz ionos termékének nevezett állandó,  = 1,0∙10 -14 22 o C hőmérsékleten.
= 1,0∙10 -14 22 o C hőmérsékleten.
A vízmolekulák disszociációja során egyenlő mennyiségben képződnek hidrogén- és hidroxil-ionok, ezért koncentrációjuk is azonos (semleges oldat). A koncentrációk egyenlősége és a víz ionos termékének ismert értéke alapján megvan
[H + ] =  =
= = 1∙10 -7 . (4.3)
= 1∙10 -7 . (4.3)
A hidrogénionok koncentrációjának kényelmesebb kifejezésére P. Sarensen vegyész (dán fizikai kémikus és biokémikus) bevezette a pH fogalmát. ( p a dán Potenz szó kezdőbetűje – fok, H a hidrogén vegyjele).
A hidrogén pH-értéke az oldatokban lévő hidrogénionok koncentrációját (aktivitását) jellemzi. Számszerűen megegyezik a hidrogénionok koncentrációjának decimális logaritmusával  , ellenkező előjellel vesszük, azaz.
, ellenkező előjellel vesszük, azaz.
 pH = -
lg
pH = -
lg
 .
(4.4)
.
(4.4)
A vizes oldatok pH-ja 1 és 15 közötti tartományban lehet. Semleges oldatokban 22 o C hőmérsékleten pH = 7, savas oldatokban< 7, в щелочных рН > 7.
Amikor a szabályozott oldat hőmérséklete megváltozik, az üvegelektróda elektródpotenciálja megváltozik az együttható jelenléte miatt S
=
2,3∙ a (4.1) egyenletben. Ennek eredményeként ugyanaz a pH-érték különböző oldat-hőmérsékleten megfelel az elektródarendszer különböző emf-értékeinek.
a (4.1) egyenletben. Ennek eredményeként ugyanaz a pH-érték különböző oldat-hőmérsékleten megfelel az elektródarendszer különböző emf-értékeinek.
Az elektródarendszer emf-jének a pH-tól való függése különböző hőmérsékleteken egy csomó egyenes vonal (4.1. ábra), amelyek egy pontban metszik egymást. Ez a pont az oldat pH-értékének felel meg, amelynél az elektródarendszer emf-je nem függ a hőmérséklettől; ún. izopotenciális (a görög - egyenlő, azonos és ...lehetséges) pont. Az izopotenciális pont koordinátái ( E ÉSés pH I) az elektródarendszer legfontosabb jellemzői. A hőmérsékletet figyelembe véve a statikus karakterisztika (4.1) formát ölt
Kellő időben az első tengervizes akvárium remekmű volt. 20 gallonos volt végig üveg akvárium, szilikon ragasztóval ragasztva. A szűrőrendszer pneumatikus homokszűrőkből állt. Az én feladatom az volt, hogy támogassam két lakóját (az önzetlen hal, Beau Gregory - Stegastes leucostictus- és tengeri kökörcsin Condylactis) a lehető legboldogabbak (ami tapasztalat hiányom és korlátozott erőforrásaim miatt azt jelentette, hogy életben tartom őket). Egy magas rendelés egy 9 évesnek, 1964-ben volt. Mentorom, Mrs. Perry a Cobb Pets-től azt tanácsolta, hogy ellenőrizzem a víz fajsúlyát és a pH-t. A fajsúly meglehetősen egyszerű volt (csak dobjon egy hidrométert az akváriumba, és jelöljön meg egy bizonyos szintet, amikor friss vizet adnak hozzá), de a pH egy kicsit bonyolultabb. Ezt a paramétert úgy tesztelték, hogy színes folyadékot adtak az akváriumi vizes palackhoz. Mintha varázsütésre megváltozott volna a vízminta színe, majd összehasonlították egy színes négyzetekből álló összehasonlító táblázat segítségével. Az első tesztem eredményei alapján hozzá kellett tennem szódabikarbóna a pH-szint emelésére. Kötelességtudattal telve ezt tettem – semmi változás. Addig folytattam a folyamatot, amíg hozzá nem adtam az egész csomag szódabikarbónát.
Soha nem fogom megtudni, mi okozta a halaim és a kökörcsin halálát, de az eset közvetlenül a leírt epizód után történt. Amellett, hogy kedvenceim számára minden nagyon szomorúan végződött, a helyzet számomra pusztítóvá vált. Minden munkám, amiért hetente egy dollárt kaptam, a lefolyóban volt. A helyzetet rontotta, hogy én voltam a felelős a lakók haláláért. Az udvarunkban folyó patak páfrányokkal borított partjára temettem őket. Most úgy gondolom, hogy a folyékony reagens lejárt, ezért az eredmények tévesek voltak. Nagyon tanulságos lecke volt.
Az évek során a helyzet nem sokat változott. Ennek a kulcsfontosságú paraméternek a jelentőségének és a mutatók ellenőrzésének módjának nem ismerete, a helyes értelmezés és a szükséges intézkedések hiánya súlyos következményekkel járhat és fog is vezetni. Ami jelentősen megváltozott, az a pH-mérési módszerek és műszerek piaci elérhetősége és megfizethetősége. Ebben a cikkben megvizsgálunk néhányat, összehasonlítva előnyeiket és hátrányaikat.
pH meghatározása
A pH egy anyag savas vagy lúgos jellegének besorolása, 0-tól 14-ig terjedő skálán kifejezve, ahol a 0 nagyon savas, a 14 pedig nagyon lúgos. Semleges környezet (nem savas és nem lúgos) - 7-es mutató ezen a skálán. Savas pH-n a hidrogénionok, lúgos pH-n a hidroxiionok dominálnak.1. ábra A pH-skála logaritmikus, és a hidrogénionok aktivitási fokát mutatja.
A forrástól függően a pH jelentése "hidrogén potenciál" vagy a francia "pouvoir hydrogène" kifejezés, ami "hidrogénenergiát" jelent.
A pH mérés jelentősége
A pH a folyadékok jellemzője (esetünkben), amely befolyásolja a folyadékokat kémiai összetétel, különösen az oldhatóság tápanyagok(na jó, ha nem vittük túlzásba). Az alacsony pH-érték oldhatóvá teheti a potenciálisan mérgező nehézfémeket. A pH befolyásolja az enzimaktivitást (előnyös pH-tartományuk van). A magas pH-érték képes feloldani a sejt lipidmembránjait. U vízi élőlények van egy előnyös pH-tartomány is. Rövid áttekintés pH értékek in különböző környezetekben(az akvaristák érdeklődésére) az 1. táblázatban látható.| pH-forrás | pH |
|---|---|
| Rio Negro folyó | 5.1 |
| Esővíz | 5.6 |
| Amazon folyó (könnyű víz) | 6.9 |
| Tiszta (ivó)víz | 7 |
| Tengervíz | 8.2 |
| Tanganyika-tó (felszín) | 9 |
pH mérés
A pH meghatározásának többféle módja van. Mindegyiknek megvannak a maga előnyei és hátrányai. Kezdjük a legolcsóbbakkal.Lakmusz papír
A lakmusz egy zuzmóból származó anyag (a név az óskandináv litmosi szóból származik, jelentése "festék" és "moha/zuzmó"). Ez a lakmuszszármazék előre láthatóan megváltoztatja a színét, ha különböző pH-szinteknek van kitéve. Ez az érzékenység teszi a lakmusz egyszerű és olcsó módszert a pH meghatározására. A lakmuszpapír olyan papír, amelyhez ezeket a vízoldható színezékeket adták, és a lakmuszpapír vízmintába merítése által okozott színváltozás savas vagy lúgos környezetre utal. Az üzemi pH mérési tartomány körülbelül 5-8. A színváltozás vizsgálatát teljes spektrumú megvilágítás mellett kell elvégezni.

2. ábra. A lakmuszpapír egy olcsó, de közelítő módszer a pH mérésére.
Előnyök: olcsó (kb. 5 USA). Gyors, könnyen használható.
Hátrányok: hozzávetőleges mutatókat ad. A vízminta színe, redukálószerek és oxidálószerek befolyásolják az eredményt. Az eredmények értelmezése éles látást igényel. A reagens eltarthatósági ideje korlátozott.
Indikátor festékek
Nagyon kevés ilyen pH-mutató létezik. Vásárolhatók por vagy folyékony formában. Általában titrálást magában foglaló vizsgálatokban használják. Az alábbiakban felsoroljuk néhányuk jellemzőit:
Fenolftalein: sav/bázis indikátor, amely savas körülmények között színtelenné, lúgos körülmények között rózsaszínes-vörössé válik. Mérési tartomány ~8,3-10.
Metilnarancs (heliantin, savas azofesték): 3,7 körüli pH-szinten sárgáról vörösre változtatja a színét.
Meta-krezol ibolya: 7,4-nél narancssárga, magasabb pH-értéknél (kb. 8,8-ig) lilára változtatja a színét.
Brómtimolkék: kék 7,5-nél, zöldes ~6,2-6,8-nál és sárga 6 körül.
Univerzális indikátor: Több indikátort kombinál a széles pH-tartomány értékeléséhez.

3. ábra. Ez az API pH-teszt meta-krezolibolyát használ indikátorként.
Célszerű a színváltozásokat természetes fényben, fehér háttér előtt értékelni.
Előnyök: Viszonylag olcsó (~10 USD) Egyes színezékek más tesztek (pl. lúgosság) elvégzésére is használhatók anélkül, hogy pH-elektródát kellene használni reagens használatakor.
Hátrányok: Ugyanaz, mint a lakmuszpapírnál. Egyes színezékek pH-értéke korlátozott. Az eredményeket befolyásolhatja a tesztfolyadék zavarossága és/vagy színe. Az összehasonlítást fehér háttér előtt kell elvégezni teljes spektrumú megvilágítás mellett. A reagensek eltarthatósági ideje korlátozott – lejárati dátumot kell feltüntetni.
pH-elektródák
Tudom, hogy nehéz elképzelni új akvaristák számára, de 30 évvel ezelőtt Európán kívüli akvaristák alig hallottak pH-elektródák használatáról. A helyzet az 1980-as években megváltozott, amikor egy német cég (Dupla GmbH) korszerű berendezéseket kezdett exportálni Észak Amerika. Ma mindenhol pH-mérőket használnak. Az eszközök elérhetősége és a gyártók közötti verseny hozzájárult ahhoz, hogy az ár meglehetősen megfizethetővé vált.
A PH elektróda egy szelektív hidrogénion (H+) érzékelő. A pH-elektródák valójában két elektródát használnak, egy szondát (jelzőelektródát) és egy referenciaelektródát. Ez a két elektróda jellemzően az elektróda egyetlen házában („test”) található. Az elektródatest végén a szonda vékony, hidrogénre érzékeny üvegréteggel rendelkezik. A szonda feszültsége a hidrogénionok aktivitásától függően változik (savas környezetben a feszültség nő, lúgos környezetben csökken). A referenciaelektróda állandó feszültséget biztosít, amelyet a szondával való különbség meghatározására használunk. A teljes mV választ egy mérőeszközre (mérőóra) küldik, ahol pH értékké alakítják át.
Érzékelő szerkezet és terminológia
A pH-elektródák működésének megértéséhez meg kell érteni néhány olyan kifejezést, amelyet a kialakítására használnak, és másokat.
Ház (elektródatest): üreges cső, amely a pH-elektróda munkarészeit tartalmazza. A ház készülhet üvegből vagy vegyszerálló műanyagból, például poliéterimidből.
Puffer: Esetünkben savas, semleges vagy lúgos pH-t mutató standard oldatot használunk a pH-mérő kalibrálásához. Az azonosítás megkönnyítése érdekében néhány pufferoldat színkóddal van ellátva.
Kalibrálás: Az analitikai műszer kalibrációjának ellenőrzésének vagy beállításának folyamata.
Csatlakozás (kötés, forrasztás): Két rész kombinációja; ebben az esetben a vizsgálati anyag és a kontroll belső oldat. A csatlakozások abból készülnek különféle anyagok; Az anyagoknak porózusnak kell lenniük, hogy a kontrolloldat áthaladhasson rajtuk. Jellemzően kerámiát, szövetet stb. Vannak egy, két és gyűrűs csatlakozású elektródák.
Fritt: Részben megolvadt üveg vagy kerámia, néha kötésként használják.
ATC: Automatikus hőmérséklet-kompenzáció. Mivel az oldat pH-ja a hőmérséklettől függ, az ATC korrigálja a hőmérséklet hatásait. Az ATC hőmérséklet-érzékelőt igényel, amely beépíthető az elektródába az üvegbura közelében.
Referenciaelektróda: Ismert, állandó feszültséget biztosító elektróda; általában ezüst-klorid huzalból készülnek, és puffer elektrolittal töltik meg.
Szonda: Ezüst-klorid huzal egy csőben pH-érzékeny üvegburával a végén.


4. ábra pH-elektróda belső részletei.
Az egyértelműség kedvéért a törékeny üveglombikot körülvevő védőburkolat (kupak) nincs feltüntetve.
Egyes pH-elektródák oldalán van csatlakozás
Többféle elektróda létezik. Egyes, általában régebbi elektródák (tapasztalataim szerint ezek ma már ritkák) két külön házból állnak. Jelenleg a legtöbb elektróda kombinált érzékelő, ahol az anód és a katód külön-külön, egyetlen házban található. Az üvegbura alakja gyakran meghatározza, hogy az elektróda mit fog mérni. A gömblombikok nagy felületükkel kiválóan alkalmasak többcélú (univerzális) mérésekre vizes környezetben. Az Erlenmeyer-lombikok képesek behatolni a félszilárd anyagokba (például húsba és más élelmiszerekbe) és a talajba. A pH mérésére lapos üveg "lombikok" használhatók különböző típusok bőr stb. Egyes elektródák újrafelhasználhatók, míg mások nem, és kémiai gélekkel vannak feltöltve. Egyes elektródák eltávolítható (cserélhető) csatlakozásokkal és szondákkal rendelkeznek.
A pH-mérők rövid áttekintése
Áttekintésünk a által gyártott pH-mérőkre vonatkozik Hanna Instruments(Woonsocket, Rhode Island, USA.) A Hanna 1978 óta van a piacon, és ma több mint 3000 terméklehetőséget kínál ügyfeleinek szerte a világon. A cég néhány terméke érdekli az akvaristák figyelmét.Minden átvizsgált Hanna pH-mérőhöz tartozik kalibráló puffer, elektródatisztító oldat és hordtáska. Kezdjük áttekintésünket ezzel:
pH-ellenőrző (HI98103)

5. ábra. Megfizethető pH-ellenőrző a Hanna Instruments-től.
A HI98103 Checker® belépő szintű pH-mérő értékes kiegészítője lesz sok akvarista eszköztárának. A készülék 0,1 pH-egységet kínál. felbontás megfizethető áron. A megfizethető ár annak köszönhető, hogy a készülék mindössze két kalibrációs pontot (pH 4,01 és 7,01 vagy 7,01 és 10,01) kínál automatikus hőmérséklet-kompenzáció (ATC) vagy hőmérsékletmérési képesség nélkül. Mivel általában javasolt, hogy a kalibrációs pontok tükrözzék a várható pH-értéket, ez az eszköz jobban illeszkedik a savas édesvízi rendszerekhez, például az Amazon biotópokhoz (annak ellenére, hogy minden bizonnyal képes mérni a zátonyok és az afrikai sügérrendszerek pH-értékét, bár kisebb pontossággal a mindössze kétpontos kalibráció miatt). Az elektróda cserélhető, a csatlakozás papírból készült.Tartomány: 0-14 egység
Felbontás: 0,1 egység
Pontosság: ±0,2 egység
Kalibrációs pontok (beosztás): Kettő; pH 4,01, 7,01 vagy 10,01
Automatikus hőmérséklet kompenzáció: Nincs
Hőmérséklet mérés/kijelzés: Nincs
Cserélhető szonda: Igen
Elektróda átmérő: 8 mm (~5/16")
LCD mérete: 3/8" (~10mm)
Elem: 1-CR2032; erőforrás körülbelül 1000 óra.
pHep pH- és hőmérséklet-érzékelő (HI98107)

6. ábra pHep készülék kalibrációs pufferrel a házában.
A HI98107 pHep pH- és hőmérsékletmérő a pH-ellenőrző (fentebb leírt) modernebb változata. Amellett, hogy gyakorlatilag minden akvárium pH-tartományát meghatározza - az Amazonastól a zátonyig - a készülék a hőmérsékletet automatikus hőmérséklet-kompenzációval (ATC) is méri. A készülék két kalibrációs puffert (4,01 és 7,01) tartalmaz, a harmadik pedig elérhető (10,01, amelyet zátonyakváriumba ajánlanak). akváriumok). A csatlakozás papírból készül. Az elektróda nem cserélhető.Tartomány: 0-14 egység
Felbontás: 0,1 egység
Pontosság: ±0,1 egység
Kalibrációs pontok: három; pH 4,01, 7,01 és 10,01 (4,01 és 10,01 bemutatva)
Cserélhető érzékelő: Igen
LCD mérete: 0,3125" vagy ~8 mm
Elem: 1-CR2032; körülbelül 800 óra.
pHep5 vízálló pH- és hőmérsékletérzékelő (HI98128)
7. ábra A pHep számos funkciót kínál: pH- és hőmérsékletmérés, ATC; és lebeg a víz felszínén!
A HI98128 pHep 5 pH-mérő a Hanna zseb-pH-mérői közül a legfejlettebb. A készülék 0,01 egység felbontást kínál. ±0,05 pontossággal és automatikus hőmérséklet kompenzációval. A készülék vízálló és a víz felszínén lebeg. A készülék rugalmas megközelítést kínál a fontos mérésekhez, mert... 5 különböző kalibrációs puffer felismerésére képes.Tartomány: -2-16 egység
Felbontás: 0,01 egység
Pontosság: ±0,05 u
Kalibrációs pontok: Két lehetőség: 4.01, 7.01, 10.01 vagy 6.86, 9.18.
Automatikus hőmérséklet kompenzáció: Igen
Hőmérséklet kijelzés: Igen, ±0,5 °C pontossággal állítható °F vagy °C.
Cserélhető szonda: Igen
LCD mérete: 0,3125" vagy ~8mm (karakterméret)
Akkumulátor: 4-1,5 V-os akkumulátorok; körülbelül 300 óra
HALO vezeték nélküli terepi pH-mérő (HI12302)

8. ábra: Talán a legfejlettebb pH-elektróda a piacon, a HALO vezeték nélküli elektróda.
A HI12302 Halo Field pH Meter egy érdekes eszköz, amely sok funkciót kínál. Először is ez egy vezeték nélküli pH-elektróda, amely Bluetooth-on keresztül vezérelhető Android vagy iOS eszközökről. Még a bizonytalan felhasználók sem aggódhatnak. Tapasztalataim szerint a beállítás hihetetlenül egyszerű. Megnyitottam a Hanna Instruments weboldalát, követtem a HALO linket, és letöltöttem az alkalmazást az okostelefonomra. Az alkalmazás telepítése után (ingyenes letöltés, körülbelül 2 percet vesz igénybe), megnyitottam az alkalmazást, és a szoftver felismerte a HALO pH elektródámat. Ezután már csak a megfelelő ikonok kiválasztása szükséges az elektróda kalibrálásához, a grafikus adatok megjelenítéséhez, az érzékelő adatok megtekintéséhez stb. Őszintén hiszem, hogy ennél egyszerűbb nem is lehetne. A szoftver másodpercenként méri a pH-t és a hőmérsékletet. Az adatnaplózás biztosítja az elektróda azonosító számát, a kalibrálás dátumát, a kalibrációs pontokat, a kalibrációs görbét, a mérés dátumát és időpontját, pH-t, hőmérsékletet, millivoltokat stb. (Lásd 9-11. ábra).A szonda lehetőségek közé tartozik a gömb alakú (univerzális és vízi környezet), kúpos (élelmiszerekhez, félszilárd anyagokhoz, talajhoz stb.) és lapos csúcshoz (bőrhöz, papírhoz stb.) A HALO poliéterimid (PEI) műanyag test élelmiszerrel való érintkezésre engedélyezett, és áthatolhatatlan mindennel szemben, amit egy hűtőgép képes használja (kivéve, ha teljesen „fékmentes”, és adagoljon aromás szénhidrogéneket és/vagy részben halogénezett oldószereket a rendszerébe).
Tartomány: 0-14 egység
Felbontás: felhasználó által állítható: 0,1, 0,01 vagy 0,001 egység.
Pontosság: ±0,005 egység
Kalibrációs pontok: hét; pH 1,68, 4,01, 6,86, 7,01, 91,8, 10,01 és 12,45.
Automatikus hőmérséklet kompenzáció: Igen
Csere szonda: Nincs
Elektróda átmérő: 12 mm (~1/2")
Adatnaplózás: Igen
Akkumulátor: lítium akkumulátor, 500 óra.

10. ábra: Adatnaplózási módban a HALO elektródával kapott pH értékek táblázatként vagy...

11. ábra ... grafikon formájában. Jegyzetek készíthetők, és az adatok átvihetők Excel-táblázatokba.
Itt ellenőrizheti, hogy telefonja vagy táblagépe HALO kompatibilis-e: http://hannainst.com/halo
További információ a Hanna Instruments termékeiről itt található: http://hannainst.com
Minden Hanna érzékelőre és elektródára 6 hónap garancia vonatkozik.
Egyéb megfontolások
Most röviden beszélek más szempontokról, amelyeket figyelembe kell vennie pH-mérő vagy elektróda vásárlásakor.Csatlakozók (adapterek)
A külön elektródákkal ellátott pH-mérő eszközöket csatlakozóval kell a műszerhez csatlakoztatni (kivéve, ha arról beszélünk vezeték nélküli kapcsolattal rendelkező eszközökről, mint a Hanna HALO.) És bár a szempont csekélynek tűnik, ennek hosszú távú és esetleg költséges következményei lehetnek. Egyes gyártók speciális csatlakozókat használnak az elektródák folyamatos használatának és vásárlásának biztosítására. A legelterjedtebb a Bayonet Neill-Concelman (BNC) gyorscsatlakozó. Az amerikai csatlakozó kevésbé gyakori. Egyes európai gyártmányú készülékek S7 csatlakozót használnak.
Kapcsolatok
A pH-elektródában lévő kapcsolat két világ - az érzékelő belső megoldásának és a vizsgálati mintának - a metszéspontja (találkozása). A vegyületek, szerkezetük és geometriájuk leírására speciális kifejezéseket használnak. Amint már említettük, a csatlakozások lehetővé teszik, hogy a vezérlőelektróda oldat a tesztoldatba áramoljon. E tekintetben szennyeződésnek vannak kitéve, eltömődnek, különösen olajos minták, illetve magas fehérjetartalmú minták vagy szuszpenziók (szuszpenziós oldatok) esetében. Egyes elektródák szöveti kapcsolatot használnak. A drágább elektródák porózus kerámia anyagokat használnak. Egyes csatlakozások PTFE (politetrafluor-etilén) műanyagból készülnek, és zord környezetben való használatra tervezték, beleértve a magas szénhidrogéntartalmú környezeteket is. A PTFE illesztései néha meglehetősen nagyok, és üvegbura körüli gyűrűre hasonlítanak (a kerámia illesztései általában kicsik, csak körülbelül 1 milliméter átmérőjűek). Bármely csatlakozás szennyeződhet.
Szerencsére a zátonyakváristák számára az univerzális pH-érzékelők szövet vagy kerámia csatlakozással nagyon alkalmasak.
pH-elektródák tisztítása
Mindig érdemes emlékezni arra, hogy az elektródák a tudományos kutatás eszközei, és megfelelő gondozást igényelnek. És bár a műanyag test meglehetősen strapabíró, az üvegbura nagyon sérülékeny - a gondatlan kezelés eltörhet. A csak alkalmanként használt elektródák nem igényelnek gyakori tisztítást; Ha azonban az elektródája folyamatosan „biolevesbe” van merülve (mint egyes akváriumokban), az akvaristáknak azt tanácsoljuk, hogy rendszeresen tisztítsák meg az elektródát. Előfordul, hogy a szondát biológiai szennyeződés és fehérje borítja. A betáplálás (és a búvárszivattyúk katasztrofális meghibásodása) zsírt ad az akváriumvízhez, ami szintén hozzájárul az elektródák szennyeződéséhez. Szerencsére a tisztító megoldások segíthetnek fenntartani az elektróda működőképességét. Kövesse a gyártó utasításait. Ne dörzsölje az elektródát – mindig törölje szárazra, hogy elkerülje a statikus kisülést.
Újratölthető és nem újratölthető gélelektródák
Egyes elektródák speciálisan elkészített oldatokkal újratölthetők, míg más elektródák géllel tölthetők. Általában a gélérzékelők lassabban reagálnak a pH-szint változásaira. A legtöbb akváriumi használatra szánt érzékelő géllel van töltve.
Kalibráció
A pH-elektróda helyes kalibrálása az szükséges feltétel hogy pontos eredményeket kapjunk. A folyamat leegyszerűsödik, ha a műszer automatikus hőmérséklet-kompenzációt (ATC) kínál. A 12-14. ábrák példákat mutatnak be a hőmérséklet kalibrációs standardra gyakorolt hatására.

12. ábra: A hőmérséklet hatása a 4,01 kálium-hidrogén-ftalát pufferre.

13. ábra: A hőmérséklet hatása a kálium-dihidrogén-foszfát/nátrium-dihidrogén-foszfát puffer (6,865) pH-jára. Szerencsére a szobahőmérséklet kalibrálása meglehetősen pontos, ha nem ATC műszert használunk.

14. ábra: Egy adott puffer (nátrium-hidrogén-karbonát/nátrium-karbonát) pH-ját befolyásolhatja a hőmérséklet (egy másik eset az ATC eszköz használatához.) A légkörből származó szén-dioxid idővel befolyásolja az oldatot.
A pH-elektróda megfelelő kalibrálása egy kis türelmet és a részletekre való odafigyelést igényel. Az új jelátalakítókat megfelelően hidratálni kell (lásd a műszer utasításait). Annak ellenére, hogy egypontos kalibrálás lehetséges, kívánatos egy 2 pontos kalibrálást végezni (amely között a várható pH-értéknek esnie kell). Zátonyakváriumokhoz használjon 7.01-es és 9-es vagy 10-es puffereket. Kérjük, vegye figyelembe, hogy egyes műszerek képesek automatikusan felismerni a puffereket, ezért speciális megoldásokat igényelnek. Kalibrálás előtt ellenőrizze az elektródát, hogy nem sérült-e (különösen az üvegburán). Az üveglombiknak mentesnek kell lennie bármilyen biológiai szennyeződéstől. Ha rendelkezésre áll, használjon a gyártó által javasolt tisztítóoldatot. A megfelelő tisztítás eltávolítja a biológiai szennyeződéseket, zsírokat, fehérje szennyeződéseket stb. Az elektródát, ha újratölthető, a gyártó által javasolt oldattal kell feltölteni. Ha az elektróda tiszta és jó állapotban van, helyezze az első kalibráló oldatba. Győződjön meg arról, hogy az elektródaüveg bura és a csatlakozó teljesen bemerül a kalibráló oldatba (én 30 mm-es főzőpoharat használok, ahol 7 mm puffer elegendő a kalibrációhoz). Az elektródával erőteljesen keverje meg az oldatot (ha nem áll rendelkezésre mágneses keverő), és várja meg, amíg az elektróda és az oldat hőmérséklete kiegyenlítődik. Írja be az értéket a készülék memóriájába (általában akkor kell megnyomnia a gombot, amikor a készülék kalibrációs módban van). Öblítse le az elektródát desztillált vízzel, és törölje szárazra egy törlőkendővel (lehetőleg laboratóriumi törlőkendővel, például Kimwipes-szel). SOHA ne törölje le az elektródákat papírral – ez statikus feszültséget generálhat, amely befolyásolhatja a kalibrálást és ezáltal a leolvasást. Egyetlen kalibrációs pont esetén a folyamat befejeződött. 2 vagy 3 kalibrációs pont esetén az eljárást meg kell ismételni. Vízminta pH-értékének mérése során az oldatot kézzel vagy keverővel keverje meg, és hagyjon időt a hőmérséklet-kompenzációra. A laboratóriumi gyakorlatban javasolt a pH és a hőmérséklet rögzítése.
A kalibrációs pufferek öregítése
A legtöbb vegyszerhez hasonlóan a pH-pufferek is idővel romlanak. Egyes puffereket úgy gyártják, hogy ellenálljanak a változásoknak és hosszú (több év) eltarthatósággal rendelkezzenek. Válasszon olyan puffereket, amelyeknek a csomagoláson feltüntetett lejárati ideje van. A karbonát pufferek általában rövidebb eltarthatósággal rendelkeznek, mint a lúgos vagy savas pufferek, mivel a levegőben lévő szén-dioxidnak vannak kitéve. A kalibrálás során az elektródával érintkező puffereket el kell dobni. Ha észreveszi, hogy a puffert penész borítja (általában ez a körülbelül 4-es pufferekre vonatkozik), dobja ki. Ne használjon puffereket az akvárium pH-értékének beállításához.
A pH-elektródák tárolása
A pH-érzékelőket megfelelően kell tárolni. A legfontosabb dolog az, hogy az üveglombik hidratált maradjon. Másodszor, a kezdeti oldatnak nem szabad lehetővé tennie az ozmózist maga az oldat és az elektróda belső oldata/gélje között. Ezenkívül tartalmaznia kell egy antimikrobiális komponenst, amely megakadályozza a penészképződést és a szennyeződést.
A szükséges pH-kalibrációs pufferek, törzsoldatok és tartozékok itt tekinthetők meg: http://hannainst.com/ph-solutions
Hanna Instruments pH blogok és források
1.2. pH-elektróda útmutatók és ellenőrző listák
3. A 10 leggyakoribb hiba a pH-mérésben
4.
Az ebben a részben található cikkek letölthetők Word formátumban (szöveg és képek) és Excel formátumban (szöveg, képek, munkaszámítási töredékek)
Ha azonban mégsem szereti az előző leckében tárgyalt képeket használni, akkor ajánlhat rövid programokat, amelyek a NaCl = 0--500 μg/kg és t = 10--50 oC tartományban működnek extrapolációs hibával. akár 2 μg/kg nátriummá alakítva, ami sokkal kisebb, mint magának a mérésnek a hibája. Ezeket a programokat a Fragment.xls fájlban találja, táblázatos formában a következő:
NaCl levegővel érintkezve:
Ha a szobalevegő szén-dioxid-tartalma magasabb a számítottnál, akkor az ezekből a fragmentumokból számított NaCl koncentráció túlbecsült lesz.
Most az adataink minőségéről. Mindig őrizze meg eredeti adatait. Ha rögzítette a készülék leolvasását - elektromos vezetőképesség vagy pH -, akkor írja le a mért oldat hőmérsékletét. A pH esetében jelezze, hogy a hőmérséklet-kompenzátor be volt-e kapcsolva a mérés során, és általában nézze meg az eszköz használati utasítását, hogy mit csinál, ha a minta hőmérséklete eltér a standard hőmérséklettől. Amikor pH-értéket, vezetőképességet vagy hidrátlúgosságot határoz meg egy mintában, különösen egy magas kezdeti szén-dioxid-tartalmú mintában, ne feledje, hogy a minta már nem ugyanaz, mint amikor begyűjtötték. A mintából már ismeretlen mennyiségű szén-dioxid került a levegőbe, vagy fordítva.
Egyszer felhívtak Vinnitsaból, és megkérdezték, hogyan lehet a pH-t a hőmérsékletnek megfelelően beállítani. Lehet, hogy ezt a helyszínen kell megtenni, de lehet, hogy nem. Minden esetben jegyezze fel a minta kezdeti pH-értékét és hőmérsékletét, és biztosítson külön oszlopot a beállított pH értéknek.
Most arról, hogyan kell beállítani a pH-t. Attól tartok, hogy benne van Általános nézet Erre az „egyszerű” kérdésre száz bölcs sem tud válaszolni. Például így néz ki a pH-függés a hőmérséklettől teljesen tiszta víz esetében.

Ugyanaz, de levegővel érintkezve:


De a pH-érték korrekciója a hőmérsékletre e két grafikonon azonosnak bizonyult:

A mért pHt-ről a pH-ra t=25 °C-on ezeknél a grafikonoknál a következő képlet segítségével lehet áttérni:

Szigorúbb megközelítés lenne, ha nem 1 és 3 mg/l szabad szén-dioxidot vennénk, hanem 1 és 3 mg/l teljes (nem disszociált és disszociált) szén-dioxidot. Ha kívánja, ezt a töredéket megtalálja a 4. munkalapon, de a töredék eredményei nem térnek el jelentősen az ezen a munkalapon láthatóktól.
Ne feledje, hogy a szén-dioxidra vonatkozó töredékek olyan vizekre vonatkoznak, ahol a szén-dioxidon kívül nincsenek lúgok vagy savak, és különösen nincs ammónia. Ez csak néhány, közepes nyomású kazánnal rendelkező hőerőműben fordul elő.
PH érték, pH(lat. pondus hydrogenii- „hidrogén tömege”, kiejtve "peh") az oldatban lévő hidrogénionok aktivitásának mértéke (a koncentrációval egyenértékű erősen híg oldatokban), amely mennyiségileg kifejezi az oldat savasságát. Nagyságrendje megegyezik a hidrogénionok aktivitásának decimális logaritmusával és ellentétes előjellel, amelyet mol per literben fejeznek ki:
A pH-érték története.
Koncepció PH érték Sørensen dán vegyész vezette be 1909-ben. A mutatót ún pH (a latin szavak első betűi szerint potentia hydrogeni- a hidrogén erőssége, ill pondus hydrogeni- hidrogén tömege). A kémiában kombinációval pXáltalában olyan mennyiséget jelöl, amely egyenlő napló X, és a levél H ebben az esetben jelölje a hidrogénionok koncentrációját ( H+), vagy inkább a hidroniumionok termodinamikai aktivitása.
A pH-ra és a pOH-ra vonatkozó egyenletek.
pH érték megjelenítése.
25 °C-os tiszta vízben a hidrogénionok koncentrációja ([ H+]) és hidroxidionok ([ Ó− ]) azonosnak és 10 −7 mol/l-nek megfelelőnek bizonyulnak, ez egyértelműen következik a víz ionos termékének definíciójából, egyenlő [ H+] · [ Ó− ] és 10 −14 mol²/l² (25 °C-on).
Ha egy oldatban kétféle ion koncentrációja azonos, akkor az oldatot semlegesnek mondjuk. Ha savat adunk a vízhez, a hidrogénionok koncentrációja növekszik, és a hidroxidionok koncentrációja csökken; ha bázist adunk, ellenkezőleg, a hidroxidion-tartalom nő, a hidrogénionok koncentrációja pedig csökken. Amikor [ H+] > [Ó− ] azt mondják, hogy az oldat savasnak bizonyul, és amikor [ Ó − ] > [H+] - lúgos.
Hogy kényelmesebb legyen elképzelni, megszabadulni a negatív kitevőtől, a hidrogénionok koncentrációja helyett használja a decimális logaritmusukat, amelyet ellenkező előjellel veszünk, ami a hidrogén kitevő - pH.
A pOH oldat bázikusságának mutatója.
A fordítva valamivel kevésbé népszerű pH méret - oldat bázikussági indexe, pOH, amely egyenlő az oldatban lévő ionok koncentrációjának decimális logaritmusával (negatív). Ó − :
mint bármely 25 °C-os vizes oldatban, ami ezen a hőmérsékleten azt jelenti:
pH-értékek változó savasságú oldatokban.
- A közhiedelemmel ellentétben, pH a 0 és 14 közötti tartományon túl változhat, és túllépheti ezeket a határokat. Például hidrogénionok koncentrációja esetén [ H+] = 10–15 mol/l, pH= 15, 10 mol/l hidroxidion-koncentrációnál pOH = −1 .
Mert 25 °C-on (standard körülmények) [ H+] [Ó − ] = 10 −14 , akkor egyértelmű, hogy ilyen hőmérsékleten pH + pHOH = 14.
Mert savas oldatokban [ H+] > 10 −7 , ami azt jelenti, hogy savas oldatoknál pH < 7, соответственно, у щелочных растворов pH > 7 , pH semleges megoldások a 7. Továbbiakért magas hőmérsékletek a víz elektrolitikus disszociációs állandója nő, ami azt jelenti, hogy a víz ionos terméke nő, akkor semleges lesz pH= 7 (ami egyidejűleg megnövekedett koncentrációknak felel meg, mint H+, így Ó−); csökkenő hőmérséklet mellett, éppen ellenkezőleg, semleges pH növeli.
A pH-érték meghatározásának módszerei.
Az érték meghatározására többféle módszer létezik pH megoldásokat. A hidrogénindexet indikátorokkal hozzávetőlegesen becsülik meg, és pontosan mérik pH-méterrel vagy analitikusan meghatározva sav-bázis titrálással.
- A hidrogénionok koncentrációjának durva becsléséhez gyakran használjuk sav-bázis indikátorok- szerves festékanyagok, amelyek színe attól függ pH környezet. A legnépszerűbb indikátorok: lakmusz, fenolftalein, metilnarancs (metilnarancs) stb. Az indikátorok két különböző színű formában lehetnek - savas vagy bázikus. Az összes indikátor színe a saját savtartalmán belül változik, gyakran 1-2 egység.
- A munkamérési intervallum növelésére pH alkalmaz univerzális indikátor, amely több mutató keveréke. Az univerzális indikátor egymás után változtatja a színét pirosról sárgára, zöldre, kékre ibolyára, amikor savas területről lúgosra vált. Definíciók pH az indikátor módszer használata zavaros vagy színes oldatok esetén nehéz.
- Egy speciális eszköz használata - pH-méter - lehetővé teszi a mérést pH szélesebb tartományban és pontosabban (akár 0,01 egység pH), mint a mutatók használata. Ionometrikus meghatározási módszer pH egy galvánkör emf-jének millivoltméteres ionométerrel történő mérésén alapul, amely üvegelektródát tartalmaz, amelynek potenciálja az ionkoncentrációtól függ H+ a környező megoldásban. A módszer rendkívül pontos és kényelmes, különösen az indikátorelektróda kiválasztott tartományban történő kalibrálása után pH, amely lehetővé teszi a mérést pHátlátszatlan és színes oldatok, ezért gyakran használják.
- Analitikai térfogati módszer — sav-bázis titrálás— pontos eredményeket ad az oldatok savasságának meghatározására is. Ismert koncentrációjú oldatot (titrálószert) csepegtetünk a vizsgált oldathoz. Ha összekeverik, megtörténik kémiai reakció. Az ekvivalenciapontot - azt a pillanatot, amikor pontosan elegendő titrálószer van a reakció befejezéséhez - indikátor segítségével rögzítjük. Ezt követően, ha ismert a hozzáadott titrálóoldat koncentrációja és térfogata, meghatározzuk az oldat savasságát.
- pH:
0,001 mol/l HCl 20 °C-on van pH=3, 30 °C-on pH=3,
0,001 mol/l NaOH 20 °C-on van pH=11,73, 30 °C-on pH=10,83,
A hőmérséklet hatása az értékekre pH a hidrogénionok (H +) eltérő disszociációjával magyarázható, és nem kísérleti hiba. A hőmérsékleti hatás nem kompenzálható elektronikusan pH-méter.
A pH szerepe a kémiában és a biológiában.
A környezet savassága fontos a legtöbb kémiai folyamathoz, és egy adott reakció előfordulásának lehetősége vagy eredménye gyakran függ attól, pH környezet. Egy bizonyos érték megtartása érdekében pH a reakciórendszerben laboratóriumi kutatások vagy gyártás során olyan pufferoldatokat használnak, amelyek lehetővé teszik a szinte állandó érték fenntartását pH ha hígítják, vagy ha kis mennyiségű savat vagy lúgot adnak az oldathoz.
PH érték pH gyakran használják különféle biológiai közegek sav-bázis tulajdonságainak jellemzésére.
A biokémiai reakciók szempontjából nagy jelentősége van az élő rendszerekben előforduló reakcióközeg savasságának. A hidrogénionok koncentrációja az oldatban gyakran befolyásolja a fehérjék és nukleinsavak fizikai-kémiai tulajdonságait, biológiai aktivitását, ezért a szervezet normális működése szempontjából a sav-bázis homeosztázis fenntartása kiemelten fontos feladat. Az optimális dinamikus karbantartása pH biológiai folyadékok a szervezet pufferrendszereinek hatása alatt érhető el.
BAN BEN emberi test A különböző szervekben a pH-érték eltérő.
|
Néhány jelentés pH. |
|
|
Anyag |
|
|
Elektrolit az ólom akkumulátorokban |
|
|
Gyomorlé |
|
|
Citromlé (5%-os citromsav oldat) |
|
|
Élelmiszer-ecet |
|
|
Coca Cola |
|
|
Almalé |
|
|
Bőr egészséges ember |
|
|
Tiszta víz 25 °C-on |
|
|
Tengervíz |
|
|
Szappan (zsír) kézre |
|
|
Ammónia |
|
|
Fehérítő (fehérítő) |
|
|
Tömény lúgoldatok |
|