A venlafaxin antidepresszáns alkalmazása krónikus fájdalom szindrómában szenvedő betegeknél. Antidepresszánsok: melyik a jobb? A jogorvoslatok áttekintése Az antidepresszánsok enyhítik az izomfájdalmat
8938 0
amitriptil
Antidepresszánsok (triciklikusok)
Kiadási űrlap
Drazsé 25 mgCaps. 50 mg
R-r d/in. 20 mg/2 ml
asztal 5 mg, 10 mg
Tabletta, p.o., 10 mg, 25 mg
A cselekvés mechanizmusa
Az amitriptilin antidepresszáns hatásának mechanizmusa a neurotranszmitterek neuronális újrafelvételének gátlásával függ össze az idegvégződések preszinaptikus membránjai által, ami növeli az adrenalin és a szerotonin koncentrációját a szinaptikus hasadékban, és aktiválja a posztszinaptikus impulzusokat. Hosszan tartó használat esetén az amitriptilin normalizálja az adrenerg és szerotonerg transzmissziót, helyreállítja ezeknek a rendszereknek az egyensúlyát, depressziós állapotokban. Ezenkívül az amitriptilin blokkolja a hisztamin és az M-kolinerg receptorokat. Az M-kolinerg receptorokhoz való nagy affinitása az amitriptilin központi és erős perifériás antikolinerg hatását is okozza.Az amitriptilin nyugtató hatású.
Fő hatások
■ A pszichotróp hatás a használat megkezdését követő 2-3 héten belül kialakul: szorongásos-depressziós állapotban a szorongás, izgatottság és depressziós megnyilvánulások csökkennek.■ Az ágybavizelésre szolgáló gyógyszerek hatékonysága nyilvánvalóan elsősorban a perifériás antikolinerg aktivitással függ össze.
■ Az amitriptilin központi fájdalomcsillapító hatással bír, amelyről úgy tartják, hogy a központi idegrendszerben a monoaminok (különösen a szerotonin) koncentrációjának változásaival és az endogén opioidrendszerekre gyakorolt hatásokkal függ össze. Erősíti az opioid fájdalomcsillapítók hatását.
■ Vezetéskor Általános érzéstelenítés Az amitriptilin csökkenti a vérnyomást és a testhőmérsékletet.
■ Csökkenti a nyálmirigyek szekrécióját.
■ Egyértelmű a gyógyszerek hatása a bulimiás betegeknél, mind depresszió nélkül, mind annak jelenlétében.
Farmakokinetika
A felszívódás magas. Az amitriptilin biohasznosulása különböző beadási módok esetén 30-60%, fő metabolitja, a nortriptilin 46-70%. A plazmafehérjékkel való kapcsolat akár - 96%, a maximális 0,04-0,16 mcg/ml plazmakoncentráció orális beadás után 2,0-7,7 órával érhető el. Egyenlő dózisok esetén kapszula bevétele esetén a maximális koncentráció alacsonyabb, mint a tabletták alkalmazásakor, ami kevésbé okoz kardiotoxikus hatást. Eloszlási térfogat - 5-10 l/kg. Az amitriptilin terápiás vérkoncentrációja 50-250 ng/ml, a nortriptiliné - 50-150 ng/ml. Mindkét vegyület könnyen átjut a hisztohematikus gáton, beleértve a vér-agy és a placenta gátat, és behatol a anyatej.Az amitriptilin a májban metabolizálódik a citokróm CYP2C19, CYP2D6 enzimrendszerének részvételével, demetilezési, hidroxilezési és N-oxidációs folyamatokon megy keresztül, aktív metabolitok (nortriptilin, 10-hidroxi-amitriptilin) és inaktív vegyületek képződésével. "First pass" hatása van a májon keresztül. 2 héten belül a beadott adag 80%-a főként metabolitok formájában ürül ki a vesén keresztül, részben a széklettel. Az amitriptilin T1/2 - 10-26 óra, nortriptilin - 18-44 óra.
Javallatok
■ Az amitriptilin hatásos krónikus betegeknél fájdalom szindróma(különösen krónikus neurogén fájdalom esetén: posztherpetikus neuralgia, poszttraumás neuropátia, diabéteszes vagy egyéb perifériás neuropátiák).■ Fejfájás és migrén (megelőzés).
■ Depresszió, különösen különböző természetű szorongásos, izgatottsági és alvászavarokkal (endogén, involúciós, reaktív, neurotikus, gyógyászati, szerves agykárosodással, alkoholelvonással), a mániás-depressziós pszichózis depresszív fázisa, skizofrén pszichózisok, vegyes érzelmi zavarok .
Használati utasítás és adagolás
Az amitriptilint orálisan, intramuszkulárisan és intravénásan írják fel.A migrén megelőzésére, a neurogén jellegű krónikus fájdalomra (beleértve a hosszú távú fejfájást is) - napi 12,5-25-100 mg (a maximális adagot éjszaka kell bevenni).
Ellenjavallatok
■ Túlérzékenység.■ Zárt szögű glaukóma.
■ Epilepszia.
■ Prosztata hiperplázia.
■ A hólyag atóniája.
■ Paralitikus bélelzáródás, pylorus stenosis.
■ Szívinfarktus anamnézisében.
■ MAO-gátlókkal kombinált alkalmazás.
■ Terhesség.
■ Laktációs időszak.
■ 6 év alatti gyermekek (injekciós formákhoz - 12 év).
Felhasználási korlátozások:
■ koszorúér-betegség a tachycardia hátterében;
■ artériás magas vérnyomás;
■ gyomorfekély gyomor és nyombél;
■ szorongásos-paranoid szindróma depresszióval (az öngyilkosság kockázata miatt).
Figyelmeztetések, terápia ellenőrzése
A kezelés megkezdése előtt meg kell határozni a vérnyomást (alacsony vagy labilis vérnyomású betegeknél ez még jobban csökkenhet).A kezelés során ellenőrizni kell a perifériás vérképet (bizonyos esetekben agranulocitózis alakulhat ki), a hosszú távú kezelés során a máj funkcionális állapotának monitorozása.
Időseknél és szív- és érrendszeri betegségekben szenvedő betegeknél a pulzusszám (HR), a vérnyomás és az elektrokardiográfiai értékek monitorozása javasolt. Az elektrokardiogramon klinikailag jelentéktelen elváltozások jelenhetnek meg (a T hullám kisimulása, az S-T szegmens depressziója, a QRS komplex kiszélesedése).
A parenterális alkalmazást csak kórházi körülmények között, orvos felügyelete mellett szabad alkalmazni, a kezelés első napjaiban ágynyugalom mellett. Óvatosan kell eljárni, ha fekvő vagy ülő helyzetből hirtelen függőleges helyzetbe mozdul.
A kezelés ideje alatt az etanol fogyasztása elfogadhatatlan.
Az amitriptilint legkorábban 14 nappal a monoamin-oxidáz-gátlók abbahagyása után írják fel. Figyelembe kell venni, hogy az amitriptilin terápiás aktivitását és a mellékhatások súlyosságát számos farmakológiai csoportba tartozó gyógyszer befolyásolja (lásd „Kölcsönhatás”).
Ha hosszan tartó kezelés után hirtelen abbahagyja a szedését, elvonási szindróma alakulhat ki.
Hajlamos betegeknél és idős betegeknél az amitriptilin főként éjszaka kiválthatja a gyógyszer okozta pszichózisok kialakulását (a gyógyszer megvonása után néhány napon belül elmúlnak).
Az amitriptilin bénulásos ileust okozhat, elsősorban azoknál a betegeknél krónikus székrekedés, időseknél vagy ágyban maradásra kényszerülő betegeknél.
Az általános vagy helyi érzéstelenítés végrehajtása előtt figyelmeztetni kell az aneszteziológust, hogy a beteg amitriptilint szed.
Az antikolinerg hatás a nyálkiválasztás csökkenéséhez és szájszárazsághoz vezet. Hosszú távú használat esetén a fogszuvasodás előfordulásának növekedése figyelhető meg. Csökken a könnytermelés és relatíve megnövekszik a könnyfolyadékban lévő nyálka mennyisége, ami kontaktlencsét használó betegeknél a szaruhártya epitéliumának károsodásához vezethet.
A riboflavin iránti igény megnőhet.
Az amitriptilin átjut az anyatejbe, és álmosságot okozhat a szoptatott csecsemőknél.
A gyermekek érzékenyebbek az akut túladagolásra, ami veszélyes és potenciálisan végzetes is lehet számukra.
A kezelés ideje alatt óvatosan kell eljárni, ha gépjárművet vezet, és más potenciálisan részt vesz veszélyes fajok fokozott koncentrációt és a pszichomotoros reakciók sebességét igénylő tevékenységek.
Óvatosan írjon fel, ha:
■ krónikus alkoholizmus;
■ bronchiális asztma;
■ a csontvelő hematopoiesisének gátlása;
■ stroke;
■ skizofrénia (a pszichózis lehetséges aktiválódása);
■ máj- és/vagy veseelégtelenség;
■ thyrotoxicosis.
Mellékhatások
Antikolinerg kolinerg blokkoló hatások:■ szájszárazság;
■ homályos látás;
■ szállásbénulás;
■ mydriasis;
■ megnövekedett intraokuláris nyomás (csak helyi anatómiai hajlamú személyeknél - az elülső kamra szűk szöge);
■ tachycardia;
■ zavartság;
■ delírium vagy hallucinációk;
■ székrekedés, bénulásos bélelzáródás;
■ vizelési nehézség;
■ csökkent izzadás.
Kívülről idegrendszer:
■ álmosság;
■ asthenia;
■ ájulás;
■ szorongás;
■ dezorientáció;
■ hallucinációk (különösen idős betegeknél és Parkinson-kórban szenvedő betegeknél);
■ szorongás;
■ izgalom;
■ motoros nyugtalanság;
■ mániás állapot, hipomániás állapot;
■ agresszivitás;
■ memóriazavar, deperszonalizáció;
■ fokozott depresszió;
■ álmatlanság, „rémálom” álmok;
■ ásítás;
■ asthenia;
■ a pszichózis tüneteinek aktiválása;
■ fejfájás;
■ myoclonus;
■ dysarthria;
■ a kis izmok, különösen a karok, kezek, fej és nyelv remegése;
■ perifériás neuropátia (paresztézia);
■ myasthenia gravis;
■ ataxia;
■ extrapiramidális szindróma;
■ a görcsrohamok gyakorisága és felerősödése;
■ változások az elektroencefalogramban.
■ tachycardia;
■ szívverés;
■ szédülés;
■ ortosztatikus hipotenzió;
■ nem specifikus változások az elektrokardiogramban (S-T intervallum vagy T hullám) olyan betegeknél, akik nem szenvednek szívbetegségben; aritmia; vérnyomás labilitás; intraventrikuláris vezetési zavar (a QRS komplex kiszélesedése, a P-Q intervallum változása, köteg elágazás blokkja).
Az emésztőrendszerből:
■ hányinger.
Ritkán:
■ a nyelv sötétedése;
■ megnövekedett étvágy és testtömeg vagy csökkent étvágy és testtömeg;
■ szájgyulladás, ízváltozás (savanyú-keserű íz a szájban);
■ hepatitis (beleértve a májműködési zavarokat és a kolesztatikus sárgaságot);
■ gyomorégés;
■ hányás;
■ gastralgia;
■ hasmenés.
Az endokrin rendszerből:
■ hipo- vagy hiperglikémia;
■ csökkent glükóztolerancia;
■ diabetes mellitus;
■ hyponatraemia (csökkent vazopresszin termelés);
■ az antidiuretikus hormon nem megfelelő szekréciójának szindróma.
A reproduktív rendszerből:
■ a herék méretének növekedése (duzzanata);
■ gynecomastia;
■ az emlőmirigyek méretének növekedése;
■ az ejakuláció zavarai vagy késése;
■ a libidó csökkenése vagy növekedése;
■ csökkent potencia.
A vérrendszerből:
■ agranulocitózis;
■ leukopenia;
■ thrombocytopenia;
■ purpura;
■ eozinofília.
Allergiás reakciók:
■ bőrkiütés;
■ bőrviszketés;
■ csalánkiütés;
■ fényérzékenység;
■ az arc és a nyelv duzzanata.
Egyéb hatások:
■ hajhullás;
■ fülzúgás;
■ duzzanat;
■ hyperpyrexia;
■ megnagyobbodott nyirokcsomók;
■ vizeletvisszatartás;
■ pollakiuria;
■ hipoproteinémia.
Helyi reakciók (a / bevezetőben):
■ thrombophlebitis;
■ lymphangitis;
■ égő érzés;
■ bőrreakciók.
Túladagolás
Tünetek: a hatás a túladagolás után 4 órával alakul ki, maximum 24 óra múlva éri el és 4-6 napig tart. Ha túladagolás gyanúja merül fel, különösen gyermekeknél, a beteget kórházba kell helyezni.A központi idegrendszer oldaláról:
■ álmosság;
■ kábulat;
■ kóma;
■ ataxia;
■ hallucinációk;
■ szorongás;
■ pszichomotoros izgatottság;
■ csökkent koncentrációs képesség;
■ dezorientáció;
■ zavartság;
■ dysarthria;
■ hiperreflexia;
■ izommerevség;
■ koreoathetózis;
■ rohamok.
A szív- és érrendszerből:
■ a vérnyomás csökkenése;
■ tachycardia;
■ aritmia;
■ az intrakardiális vezetés megsértése;
■ változások az elektrokardiogramban (különösen a QRS-ben), amelyek a triciklikus antidepresszánsokkal való mérgezésre jellemzőek;
■ sokk, szívelégtelenség; nagyon ritka esetekben - szívmegállás.
Egyéb:
■ légzésdepresszió;
■ légszomj;
■ cianózis;
■ hányás;
■ mydriasis;
■ fokozott izzadás;
■ oliguria vagy anuria.
Kezelés: gyomormosás, recept aktív szén, hashajtók (túladagolás szájon át szedve); tüneti és támogató terápia; a kolinerg receptorok blokkolása által okozott súlyos tünetek esetén kolinészteráz-gátlók adása (a fizosztigmin alkalmazása nem javasolt a rohamok fokozott kockázata miatt); a testhőmérséklet, a vérnyomás és a víz-elektrolit egyensúly fenntartása.
A szív- és érrendszer funkcióinak 5 napig tartó monitorozása (48 óra elteltével vagy később is előfordulhat relapszus), görcsoldó terápia, mesterséges lélegeztetés és egyéb újraélesztési intézkedések szükségesek. A hemodialízis és az erőltetett diurézis hatástalanok.
Kölcsönhatás
Szinonimák
Amizol (Szlovénia), Amirol (Ciprus), Adepren (Bulgária), Amineurin (Németország), Amiton (India), Amitriptyline (Németország, Indonézia, Lengyelország, Szlovák Köztársaság, Franciaország, Cseh Köztársaság), Amitriptyline Lechiva (Csehország), Amitriptyline Nycomed (Norvégia), Amitriptyline-AKOS (Oroszország), Amitriptyline-Grindeks (Lettország), Amitriptyline-LENS (Oroszország), Amitriptyline-Slovakofarm (Szlovák Köztársaság), Amitriptyline-Ferein (Oroszország), Apo-Amitriptyline (Kanada), Vero- Amitriptyline (Oroszország), Novo-Triptin (Kanada), Sarotene (Dánia), Sarotene retard (Dánia), Triptisol (India), Elivel (India)G.M. Barer, E.V. Zoryan
Bármilyen eredetű. Fájdalomcsillapító hatásuk nem kapcsolódik magához az antidepresszáns hatáshoz.
Hatékonyságukat tekintve összehasonlíthatóak a népi gyógymódok http://golovnieboli.ru/drugie-stati/narodnye-sredstva-ot-golovnoj-boli. A legszélesebb körben használt antidepresszánsok az amitriptilin és az imipramin (melipramin).
Az imipramint kezdetben 10 mg/nap adagban írják fel, majd az adagot hetente emelik a hatás eléréséig (maximum 150 mg/nap). A gyógyszer kisebb mértékben fejt ki nyugtató hatást, mint az amitriptilin, de kifejezett antikolinerg hatása és káros szívhatásai miatt sok beteg nem tudja sokáig szedni.
A triciklikus antidepresszánsok, különösen az amitriptilin, csökkenthetik a szívfrekvencia variabilitását, ronthatják a kardiovaszkuláris autonóm diszfunkciót és növelhetik az ortosztatikus hipotenziót. Ezért óvatosan írják fel a szív- és érrendszeri betegségekben és az autonóm neuropátiában szenvedőknek.
A szerotonin újrafelvétel-gátlók (megjegyzés: szelektívek) csak a szerotonin újrafelvételét gátolják.
A citalopram (cipramil) és a paxil, de a fluoxetin nem, önálló fájdalomcsillapító hatást fejthet ki bizonyos típusú neuropátiás fájdalom esetén - diabéteszes polyneuropathiában.
Néha fejfájás esetén alacsony dózisú triciklikus antidepresszánsok és néhány rövid felezési idejű szelektív szerotoninfelvétel-gátló (citalopram) kombinációja lehetséges. A citalopram nem gátolja a mikroszómák és a májenzimek aktivitását, így a triciklusos szerekkel való kombinációja biztonságosabb.
Azonban, bár általában jól tolerálhatóak, az SSRI-k gyakran okoznak mellékhatásokat a gyomorban és a bélrendszerben, és akár növelhetik a gyomorvérzés(különösen az NPS párhuzamos szedése esetén). Emellett képesek szexuális zavart okozni (férfiaknál merevedési zavar, nőknél anorgazmia), csak fokozva a fejfájást, és az autonóm neuropátiában szenvedő betegek különösen érzékenyek lehetnek erre a mellékhatásra.
Gyenge tolerancia, csak egy triciklikus antidepresszáns hatástalansága esetén lehetséges a felvétel gátlók, valamint a szerotonin és a noradrenalin alkalmazása, például a venlafaxin (effexor), legfeljebb 225 mg / nap, duloxetin 60 mg / nap.
A cikket készítette és szerkesztette: sebészVideó:
Egészséges:
Kapcsolódó cikkek:
- Szinte mindenkinek van fejfájása időnként. A fejfájás egyike a 20 leggyakoribb...
- Úgy tűnik, nincs semmi különös, ha fáj a feje. Igen, minden második embernek megvan. De vannak fájdalmak...
- Fejfájás (HA) különböző anyagok ismételt bevitele esetén fordulhat elő. Az úgynevezett...
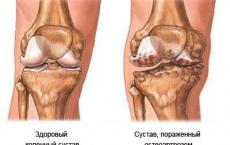
éles fájdalom evolúciósan az védelmi mechanizmus exo- vagy endogén károsodásra, és a nociceptív rendszer továbbítja
krónikus fájdalom gyakrabban ez egy nem megfelelően magas, elhúzódó és tartós válasz bizonyos károsító tényezőkre, és mind nociceptíven továbbítható, mind a kóros interneuronális impulzuskeringés alapján, főként központi szinten - neuropátiás fájdalom.
Ezen elképzelések alapján hagyományosan nociceptív fájdalom kezelésére használják fájdalomcsillapítók vagy nem szteroid gyulladáscsökkentők (NSAID-ok). A neuropátiás fájdalom kezelésére gyógyszereket használnak antidepresszánsok és antiepileptikumok (AD és AED), amelyek a neurotranszmitter rendszerre hatnak.
Neuropátiás fájdalom szindrómában szenvedő betegeknél:
elérhető panaszokégő, szúró, lövöldözős vagy sajgó fájdalmak esetén, amelyeket remegés, paresztézia, zsibbadás kísér
jellegzetes allodynia– normál, nem fájdalmas ingerek által kiváltott fájdalomérzet
a fájdalom általában fokozódikéjszaka vagy fizikai aktivitás közben
Krónikus fájdalom szindróma (CPS) megállapításakor (a daganatos eredetű CPS kivételével) meg kell határozni, hogy milyen jellegű (perifériás neuropátiás fájdalom, centrális neuropátiás fájdalom vagy neuropátiával nem összefüggő fájdalom) van a páciensben, befolyásolja a terápiás taktikát:
Perifériás neuropátiás fájdalom
Komplex helyi fájdalom szindróma
HIV által okozott neuropátia
Idiopátiás perifériás neuropátia
Fertőzés
Anyagcserezavarok
Alkohol, toxinok
Diabéteszes neuropátia
Tápanyaghiány
Idegkompresszió
Fantom végtagfájdalom
Postherpetikus neuralgia
Trigeminus neuralgia stb.
Központi neuropátiás fájdalom
Sclerosis multiplex
myelopathia
Parkinson kór
Stroke utáni fájdalom stb.
Fájdalom, amely nem kapcsolódik neuropátiához vagy nem neuropátiás (a neuropátiás fájdalom elemei átfedhetik a fő tüneteket)
Ízületi gyulladás
Osteoarthritis
Krónikus ágyéki fájdalom
Krónikus nyaki fájdalom
Fibromyolgia
Poszttraumás fájdalom stb.
NB!!!Fájdalomimpulzusok átvitele a gerincvelőn és az agyon keresztül:
serkentő és gátló neurotranszmitterek részvételével végezzük
a nátrium- és kalciumcsatornák aktivitásának mértéke korlátozza.
Norepinefrin, szerotoninés a legnagyobb mértékben gamma-amino-vajsav(GABA) a fájdalom átvitelének fiziológiás inhibitorai.
AntidepresszánsokÉs antiepileptikumok csökkenti a fájdalom súlyosságát ezen neurotranszmitterek és ioncsatornák befolyásolásával.
Triciklikus antidepresszánsok (TCA):
befolyásolja a fájdalom átvitelét a gerincvelő szintjén, gátolja a noradrenalin és a szerotonin újrafelvételét, amelyek felhalmozódva gátolják a fájdalomimpulzusok átvitelét
A H1-receptor agonizmus és a kapcsolódó szedáció korrelál a TCA-k fájdalomcsillapító hatásaival
Az amitriptilin akut fájdalomban szenvedő betegeknél is hatásos.
A TCA-kat kényelmesen szekunder és tercier aminszármazékokra osztják:
szekunder aminok(nortriptilin, dezipramin) meglehetősen szelektíven blokkolják a norepinefrin neuronális felvételét
tercier aminok(amitriptilin, imipramin) szinte egyformán gátolják a noradrenalin és a szerotonin felvételét, emellett kifejezett antikolinerg hatásuk is van.
"Új antidepresszánsok" venlafaxin és duloxetin:
gátolja a noradrenalin és szerotonin neuronális újrafelvételét anélkül, hogy más neuroreceptorokat befolyásolna
nincs antikolinerg hatásuk
A bupropion hatásmechanizmusa dopamin-újrafelvétel gátlásával jár (a gyógyszer egyéb hatásmechanizmusai nem teljesen ismertek).
Antiepileptikumok (AED):
gátolja a gerjesztést az idegsejtekben
fokozza a gátlást
Ezek a gyógyszerek befolyásolják:
feszültségfüggő nátrium- és kalciumioncsatornák
ligandum-kapuzott ioncsatornák
glutamát és N-metil-D-aszpartát specifikus receptorai
gerjeszti a glicin és GABA receptorokat
Az AD és az AED klinikai hatékonysága CHD-ben
Neuropátiás fájdalom
1. Klinikai vizsgálatok igazolták a TCA-k hatékonyságát a neuropátiás fájdalom kezelésében.
2. Más AD-k változó hatást mutatnak ebben a patológiában
A nem szelektív vagy noradrenerg aktivitású AD-k a leghatékonyabbak neuropátiás fájdalom esetén.
A neuropátiás és nem neuropátiás fájdalomszindrómák kezelésében az összes AD közül az amitriptilin és a nortriptilin rendelkezik a legnagyobb bizonyítékkal.
A TCA-k hatása korrelál antidepresszáns hatásukkal.
A szerotonerg hatású gyógyszerek (például a fluoxetin) általában hatástalanok a CHD kezelésében.
3. Hagyományosan a neuropátiás fájdalomban szenvedő betegek kezelésében AED-ket alkalmaznak, és az első generációs karbamazepin gyógyszert gyakrabban alkalmazzák, mint másokat, különösen akkor, ha:
trigeminus
posztherpetikus neuralgia
fájdalom szindróma a diabéteszes neuropátia hátterében
A fájdalomcsillapítás gyakorisága trigeminus neuralgiában karbamazepin szedése közben A különböző szerzők szerint 58-90%-on belül változik, diabéteszes neuropathiában pedig eléri a 63%-ot, ami a gazdasági elérhetőség mellett meghatározza a gyógyszer széleskörű alkalmazását ezekben a betegségekben.
4. A második generációs AED-ek is meggyőző alappal rendelkeznek a neuropátiás fájdalom hatékonyságát illetően. A klinikai vizsgálatok során a gabapentin hatékonyabbnak bizonyult, mint a placebó diabéteszes neuropátiában és posztherpetikus neuralgiában szenvedő betegeknél. A pregabalin hasonló tulajdonságokkal rendelkezik.
5. A lamotrigin hatásosnak bizonyult:
trigeminus neuralgia
HIV-fertőzéssel összefüggő neuralgia
post-stroke fájdalom szindróma
nem specifikus refrakter neuropátiás fájdalom
A lamotrigin hosszú távú alkalmazását nagymértékben korlátozza az életveszélyes bőrreakciók kockázata.
6. Az AD és az AED-k hatékonysága általában összehasonlítható CHD esetén, az egyetlen különbség a gyógyszerek használatában és tolerálhatóságában van e csoportokon belül.
Nem neuropátiás fájdalom
1. A legtöbb esetben a TCA-k hatásosak különböző nem neuropátiás fájdalomszindrómák esetén (bár hatásuk súlyossága idővel csökkenhet), más AD-k és AED-k nem mutatnak hatást ezekben az állapotokban.
2. Az AD-k átlagos hatékonysággal csökkentik a fájdalom és a szorongás súlyosságát, javítják az alvást és a fibromyalgiában szenvedő betegek általános állapotát.
3. A fluoxetin napi 80 mg-os dózisban jelentős hatással van a fibromyalgiával összefüggő fájdalomra, napi 20 mg-os dózisban nincs hatása.
4. A PEP-ből hatékony eszközök A duloxetin és a pregabalin a fibromyalgia kezelésére alkalmas.
5. Az AD-k jelentős (de gyenge) hatással vannak a krónikus ágyéki fájdalomra. A legkevesebb hatást a túlnyomó szerotonerg aktivitású AD fejti ki.
Tájékoztatás a CHD kezelésére használható gyógyszerekről
Antidepresszánsok
1. TCA
Mellékhatások (ADR): szájszárazság, székrekedés, vizeletvisszatartás, szedáció, súlygyarapodás
Amitriptilin, imipramin 10-25 mg; hetente 10-25 mg-mal emelje 75-150 mg-os adagra éjszaka
NPR: Kifejezett antikolinerg hatás, idős korban nem alkalmazható
Dezipramin, nortriptilin 25 mg reggel vagy este; heti 25 mg-mal 150 mg-ra emeljük
NPR: Kevésbé kifejezett antikolinerg hatás
2. SSRI-k (szelektív szerotonin újrafelvétel-gátlók)
Fluoxetin, paroxetin 10-20 mg/nap, legfeljebb 80 mg/nap fibromyalgia esetén
Mellékhatások: hányinger, szedáció, csökkent libidó, fejfájás, súlygyarapodás; krónikus szívbetegség esetén a hatás gyenge
3. „Új” antidepresszánsok
Bupropion 100 mg/nap, heti 100 mg-mal növelve napi kétszer 200 mg-ra
ADR: szorongás, álmatlanság vagy szedáció, fogyás, görcsrohamok (450 mg/nap feletti adagok esetén)
Venlafaxin 37,5 mg/nap, heti 37,5 mg-mal 300 mg/napra emelve
NDP: fejfájás, hányinger, fokozott izzadás, szedáció, artériás magas vérnyomás, görcsrohamok; szerotonerg hatások 150 mg/nap alatti dózisban; szerotonin és noradrenerg hatások 150 mg/nap feletti dózisok esetén
Duloxetin 20-60 mg/nap 1-2 adagban depresszió esetén, 60 mg/nap fibromyalgia esetén
Mellékhatások: hányinger, szájszárazság, székrekedés, szédülés, álmatlanság
Antiepileptikumok
I generáció
karbamazepin (finlepsin) 200 mg/nap, növelje heti 200 mg-mal napi 3-szor 400 mg-ra (1200 mg/nap)
Mellékhatások: szédülés, diplopia, hányinger, aplasztikus anémia
100 mg fenitoin éjszaka, az adag hetente 500 mg-ra emelve éjszaka
NDR: hányinger, szédülés, ataxia, beszédzavar, nyugtalanság, hematopoietikus rendellenesség, hepatotoxicitás
II generáció
Gabapentin 100-300 mg éjszaka, 3 naponta 100 mg-mal emelve napi 1800-3600 mg-ra, 3 részre osztva
ADR: álmosság, fáradtság, szédülés, hányinger, szedáció, súlygyarapodás
Pregabalin 150 mg éjszaka diabéteszes neuropátia esetén; 300 mg naponta kétszer posztherpetikus neuralgia esetén
ADR: álmosság, fáradtság, nyugtatás, szédülés, hányinger, súlygyarapodás
Lamotrigin 50 mg/nap, kéthetente 50 mg-mal emelve napi 400 mg-ig
Mellékhatások: álmosság, székrekedés, hányinger, ritkán életveszélyes bőrreakciók
I. Akut, krónikus és kóros fájdalom. A krónikus fájdalom patofiziológiai és klinikai jellemzői. A krónikus fájdalom szindrómák fő típusai. A krónikus fájdalom neurokémiája.
Akut fájdalom- bármilyen hirtelen fellépő patológia vagy szövetkárosodás tünete. Az akut fájdalom szindrómát fiziológiásnak nevezhetjük, mivel bizonyos védelmi funkciót lát el, és jelezve a szövetekben a kóros folyamatok kialakulását, hozzájárul az adaptív komplex reakciók kialakulásához a szervezetben. Az akut fájdalom terápiája általában a fájdalmat kiváltó ok megszüntetésére, vagy algogén hatásának (blokád) csökkentésére irányul.
Krónikus vagy visszatérő fájdalom
többkomponensű eredetű, amely nemcsak kórélettani, hanem szorosan kölcsönható pszichológiai és szociális tényezőkön is alapul. A krónikus fájdalmat kóros fájdalomnak is nevezik, mivel a szervezet számára kórokozó jelentőséggel bír, és a központi idegrendszer működési zavarait, mentális és érzelmi zavarokat okozva belső szervek károsodásához vezet.
A krónikus (kóros) fájdalom független betegség, amelynek elsődleges kóros folyamata a szomatikus szférában és a perifériás és központi idegrendszer másodlagos diszfunkciója.
A fő különbségek a krónikus (kóros) fájdalom között:
u időtartam (legalább 3-6 hónap),
u növeli a beteg terápiával szembeni ellenállását,
u a közvetlen függőség hiánya az azt okozó ok azonosításától és megszüntetésétől.
A krónikus fájdalom típusai:
1) Folyamatos, hosszan tartó expozíció következtében fellépő fájdalom (csigolyaközi porckorongsérv).
2) Fájdalom akut sérülés után, de a normál gyógyulási periódusnál jóval tovább tart (kauzalgia, regionális fájdalom szindróma, fantomfájdalom).
3) Konkrét, látható, észrevehető ok nélküli fájdalom (izomfeszültségi fejfájás, migrén).
§ Krónikus fájdalom önálló betegség, melynek patogenezisében pszicho-érzelmi és szociális tényezők játszanak vezető szerepet. Az ilyen típusú fájdalom esetén előfordulhat, hogy nincs közvetlen kapcsolat a fájdalom és az azt okozó ok között.
§ A krónikus fájdalom és depresszió kialakulásának mechanizmusai közös közvetítő rendszereket foglalnak magukban.
§ Epidemiológiai vizsgálatok szerint erős kapcsolat van a depresszió és a krónikus fájdalom között.
A krónikus fájdalomnak többféle osztályozása létezik.
Legtöbbjük a fájdalom szindróma lokalizációján alapul:
o fejfájás,
o nyak- és hátfájás,
o arcfájdalom,
o végtag fájdalom,
o mellkasi fájdalom,
o hasi fájdalom,
o fájdalom a medencében.
Vannak fájdalmak is szomatikus eredet, neurogén És pszichogén fájdalom.A krónikus fájdalom kialakulásának mechanizmusaiban, függetlenül annak helyétől és eredetétől, fontos szerepet kapnak az agy és a gerincvelő mediátor rendszerei:
v Szerotonerg
v Noradrenerg
v Dopaminerg
v GABAergic
v Peptiderg (opioid és nem opioid).
Számos klinikai és kísérleti tanulmány megállapította:
- A szerotonin intratekális beadása fájdalomcsillapítást okoz, és gátolja a gerincvelő hátsó szarv neuronjainak fájdalmas stimuláció által okozott aktivitását.
- Ha az agy bizonyos területeire (a raphe nucleus magnum) szerotonin újrafelvételt gátló szereket juttatnak be, ami elősegíti a szerotonin felszabadulását a szinaptikus terminálisokból, fájdalomcsillapító hatás alakul ki.
- A leszálló szerotonerg utak szelektív megszakítása fokozza a fájdalomreakciót.
Az adrenerg mediátor rendszer hatásának vizsgálatakor hasonló eredményeket kaptunk. Azt találták, hogy a noradrenalin modulálja a fájdalomjeleket mind a szupraszegmentális, mind a spinális szinten. Ennek eredményeként az adrenerg receptor blokkolók növelik a fájdalomérzékenységet, az agonisták (klonidin) pedig gátolják a nociceptív neuronok aktivitását a fájdalmas stimuláció hatására.
II. Krónikus fájdalom és depresszió.
Számos klinikai és epidemiológiai vizsgálat eredménye alapján megállapították, hogy szoros kapcsolat van a krónikus fájdalom és a depresszió között. A krónikus fájdalomban szenvedő betegek körében a depresszió prevalenciája 30-87%. Egyes kutatók szerint a depresszió a krónikus fájdalomban szenvedő betegek csökkent munkaképességének vezető tényezője, vagy a legjelentősebb motiváció az orvosi segítség igénybevételekor.A depressziós rendellenességek és a krónikus fájdalom kapcsolata nem tűnik egyértelműnek, és számos ok-okozati összefüggéseik alternatív lehetőségei:
1) A krónikus fájdalom a depresszió oka.
2) A depresszióban szenvedő betegek nagyobb valószínűséggel tapasztalnak fájdalmat.
3) A krónikus fájdalom és depresszió közvetve összefügg más köztes tényezőkkel (fogyatékosság).
III. A krónikus fájdalom farmakoterápiája. adjuváns terápia. Antidepresszánsok alkalmazása a krónikus fájdalom kezelésében.
A használt gyógyszerek fő csoportjai drog terápia krónikus fájdalom szindrómák:
1. Fájdalomcsillapítók
· opioidok,
· nem opioid.
2. Adjuváns fájdalomcsillapítók.
Adjuváns fájdalomcsillapítók ("koanalgetikumok")
-heterogén csoport gyógyszerek, amelyek fájdalomcsillapítást biztosítanak vagy specifikus fájdalomszindrómák esetén, vagy semlegesítik az opioidok mellékhatásait, ami lehetővé teszi fájdalomcsillapító hatásuk meghosszabbítását. Ide tartoznak azok a gyógyszerek, amelyek nem rendelkeznek közvetlen fájdalomcsillapító tulajdonságokkal, de bizonyos körülmények között beszerezhetők (antihisztaminok, nyugtatók, görcsoldók stb.). A krónikus (patológiás) fájdalom pontosan azok az állapotok, amelyek mellett az adjuváns szerek alkalmazása pozitív hatást fejt ki. Ez utóbbiak között fontos helyet foglalnak el az antidepresszánsok.
Az elterjedt klinikai gyakorlatban sajnos az antidepresszánsok orvosi felírását csak az a vágy motiválja, hogy nyugtató hatást váltsanak ki, és ezáltal kedvező hátteret teremtsenek a fő terápia (fájdalomcsillapítók) számára. Közben ismert, hogy az antidepresszánsok alkalmazása a krónikus szívbetegségben szenvedő betegek 50-60%-ánál pozitív hatást fejt ki. Több mint 60 klinikai vizsgálat szerint az antidepresszánsok fájdalomcsillapító hatása a legtöbb CHD kezelésében bizonyított.
Az antidepresszánsok három fő mechanizmuson keresztül fejtik ki fájdalomcsillapító hatásukat :
1. Csökkentse a depressziót.
2. Fájdalomcsillapítók vagy endogén opiát peptidek hatásának fokozása.
3. Megvannak a saját fájdalomcsillapító tulajdonságaik, amelyek a noradrenalin és a szerotonin szinaptikus aktivitásának hosszú távú meghosszabbításában állnak.
Az antidepresszánsok alkalmazásának általános javallata az HBS , de egyes fájdalomszindrómák kötelező indikációi az alkalmazásuknak.
Ezek tartalmazzák :
· neurogén fájdalom szindrómák (diabetikus neuropátia, herpetikus neuropátia, kauzalgia stb.),
· bizonyos típusú elsődleges fejfájás (izomfeszültség fejfájás, migrén, abúzus fejfájás stb.).
IV. Farmakoterápia antidepresszánsokkal CHD esetén.
Az antidepresszánsokat krónikus fájdalom szindróma kezelésére használják.
Antidepresszánsok - a neurotranszmitterek neuronális felvételének gátlói:
v válogatás nélkül;
v szelektív.
A nem invazív antidepresszánsok közé tartozik triciklusosÉs négy ciklusú antidepresszánsok.
1. Triciklikus antidepresszánsok:
amitriptilin,
· imipramin,
· klomipramin.
Az ebbe a csoportba tartozó gyógyszerek farmakológiai hatása a noradrenalin és a szerotonin újrafelvételének gátlása, ami ezen neurotranszmitterek felhalmozódásához vezet a receptor területén. A triciklusos antidepresszánsok kezdő adagja 10-25 mg este, lefekvés előtt, majd a napi adag 10-25 mg-mal történő emelése 3-7 naponta maximum 75 mg-ra (migrén, tenziós fejfájás) 150-re. mg (neuropathiás fájdalom). Fájdalomcsillapító hatás az első hét végére lehetséges, 2-3 héten pszichotróp hatás lép fel - javul a hangulat, javul a munkaképesség, eltűnik a fájdalom szorongó várakozása. A kezelés több hónapig tart, fokozatos visszavonással.
Mellékhatások:
a)kolinerg:
o szájszárazság,
o homályos látás,
o székrekedés,
o vizelet-visszatartás,
o sinus tachycardia,
o szédülés.
b)hisztaminerg:
o álmosság,
o hízás.
c)adrenerg:
o ortosztatikus hipotenzió,
o kardiotoxicitás.
2. Négyszeres ciklikus antidepresszánsok:
· maprotilin-ludiomil,
· mianserin-lerivon.
Jellemzőjük a noradrenerg transzmitter rendszerre gyakorolt domináns hatás. Bizonyítékok vannak a hatékonyságra Mianserina (Lerivona) fejfájás kezelésében izomfeszültség. A gyógyszer nyugtató hatású.A Mianserint jó hatással a derékfájás kezelésére használják napi 10-30 mg dózisban.
Az ebbe a csoportba tartozó gyógyszerek minimális mellékhatásokkal járnak:
o álmosság,
o hízás,
o ortosztatikus hipotenzió.
Szelektív szerotonin újrafelvétel gátlók:
§ fluoxetin-prozac,
§ venflaxin,
§ nefazodon,
§ sertralin-zoloft,
§ Paroxetine-Paxil.
A krónikus fájdalom szindróma kezelésében a szelektív inhibitorok szerepe ellentmondásos, és kevés klinikai vizsgálat bizonyítja hatékonyságukat a neurogén fájdalom kezelésében. A fluoxetin (Prozac) legismertebb a fejfájás, a migrén és különösen a krónikus tenziós fejfájás kezelésére. Napi 1 alkalommal 1 kapszula (20 mg) bevétele javasolt 6-8 héten keresztül. Az orosz szerzők (A.M. Vein, T.G. Voznesenskaya stb.) A betegek 65% -ánál jó hatást értek el. A fluoxetin statisztikailag szignifikánsan csökkenti a rohamok gyakoriságát és időtartamát.
A szelektív inhibitoroknak minimális az antikolinerg és a-drenerg hatása
valamilyen blokkoló tevékenység.
Mellékhatások:
o hányinger,
o hányás,
o szorongás
o szorongás,
o szexuális diszfunkció,
o fejfájás,
o izgalom.
A táblázat az antidepresszánsok különböző csoportjait mutatja be, amelyek hatásmechanizmusukban különböznek egymástól.
Antidepresszánsok (timoanaleptikumok, timoleptikumok)
Asztal 1.
| A. Monoamin-oxidáz inhibitorok (MAO) |
|
| A) Irreverzibilis MAO-gátlók: § Nialamid, § Fenelsine | b) Reverzibilis MAO-gátlók: § Befolum, § Feprosidnin HCL |
| B. Neuronális felvétel gátlók: |
|
| A) nem szelektív neuronális felvétel gátlók: | b) szelektív neuronális felvétel gátlók: |
2. négy ciklusú antidepresszánsok : § Maprotilin, § Mianserin | § Burtriptilin, § Fluoxetin § Nefazodon, § Paroxetin § szertralin, § Venflaxin. |
| BAN BEN. Antidepresszánsok különbözőcsoportok: § Cefedrin, § citalopram, § triptofán. |
|
| D. Más farmakológiai csoportokba tartozó antidepresszáns hatású gyógyszerek: § Ademetionin. |
|
V. Az antidepresszánsok alkalmazásának hatékonyságának felmérése a krónikus szívbetegségek kezelésében.
Az antidepresszánsok fájdalomcsillapításra való alkalmazásáról szóló jelenlegi irodalom áttekintése (Onghena, Van Houdenhove, 1992) placebo-kontrollos vizsgálatokban a következőket tartalmazza:
1. Az antidepresszánsokat szedő krónikus szívbetegségben szenvedő betegek populációjában a hatás átlagosan 74%-ban jelentkezik.
2. Az antidepresszánsok alkalmazásakor a fájdalomcsillapító hatás nagysága független a fájdalom túlnyomórészt organikus vagy pszichológiai alapjától.
3. A fájdalomcsillapító hatás mértéke nem függ a gyógyszer antidepresszáns hatásától, a maszkos depresszió jelenlététől vagy az antidepresszánsok nyugtatóként való alkalmazásától. Ennek eredményeként az alvászavarban szenvedő betegeknél erősebb nyugtató hatású antidepresszánsokat kell alkalmazni, hogy csökkentsék az altatóktól való függőség kockázatát.
4. A szelektív antidepresszánsok (szerotonin vagy noradrenalin) választásának nincs nyilvánvaló előnye. A monoamin-újrafelvétel gátlásában alacsony szelektivitással rendelkező antidepresszánsok nagyobb fájdalomcsillapító hatással rendelkeznek.
Az antidepresszánsok hatékonysága és szövődményei (McQuay et al. 1996)
| Krónikus fájdalom szindrómák | NNT (kezeléshez szükséges szám) NNT – azoknak a betegeknek a száma, akiket kezelni kell egy bizonyos hatás eléréséhez |
||
| Fájdalomcsökkentés (>50%) | Kisebb mellékhatások | Nagy mellékhatások |
|
| Diabéteszes neuropátia | 19,6 |
||
| Postherpetikus neuralgia | 19,6 |
||
| Atipikus arcfájdalom | |||
| Központi fájdalom | |||
| Imipramin | |||
| Desipramin | |||
| Kombinált TCA-k | |||
| Paroxetin | |||
| Fluoxetin | 15,3 | ||
| Mianserin | |||
Az orvosi ellátást igénylő betegek legfontosabb oka a fájdalom. A legtöbb betegséget és kóros állapotot kíséri. A fájdalom egyrészt adaptív reakció, amelynek célja a szervezet védekezőképességének mozgósítása, de az intenzív akut vagy krónikus fájdalom önmagában is erőteljes patogén tényezővé válik, ami éles aktivitáskorlátozáshoz, alvászavarhoz vezet, jelentősen csökkentve a beteg életminőségét.
Május 17-19-én Ungváron került megrendezésre a VI. tudományos és gyakorlati konferencia „Kárpát-olvasás”, melynek keretein belül a klinikai idegtudományok iskolája zajlott, amely a neurológia és a stroke fájdalomszindrómáinak diagnosztizálásával és kezelésével foglalkozott.
A „Post-stroke fájdalom szindróma” című jelentést V.N. Miscsenko (Ideggyógyászati, Pszichiátriai és Narkológiai Intézet, Harkov).
BAN BEN modern világ Az agy érrendszeri betegségei óriási egészségügyi és társadalmi problémát jelentenek. Ennek oka a lakosság magas morbiditási, mortalitási és rokkantsági szintje. Az érrendszeri betegségek szerkezetében a vezető helyet az agyi stroke - 150-200 eset / 100 ezer lakos - foglalja el. Évente körülbelül 16 millió betegnél alakul ki először agyi stroke, és körülbelül 7 millió ember hal meg emiatt. A stroke-túlélők mindössze 10-20%-a tér vissza dolgozni, és a betegek 20-43%-a igényel külső segítséget.
Az agyi stroke meglehetősen gyakori következménye a stroke utáni fájdalom, amelyet a betegek 11-53% -a észlel. A stroke utáni krónikus fájdalom leggyakoribb típusai a mozgásszervi fájdalom - az esetek 40%-ában a vállízületi fájdalom - 20%, a fejfájás - 10%, a központi stroke utáni fájdalom (CPSP) - 10%, a fájdalmas görcsösség - 7 %.
A központi stroke utáni fájdalom fájdalom szindróma, amely akut cerebrovaszkuláris baleset után alakul ki. Fájdalom és érzékszervi zavarok jellemzik a test azon részein, amelyek megfelelnek az érrendszeri elváltozás által károsodott agyterületnek. A centrális poszt-stroke fájdalom a krónikus fájdalomzavarok csoportjába tartozik, amelyek a „centrális neuropátiás fájdalom” fogalmába kapcsolódnak (Henriett K., Nanna B. et al., 2009).
A centrális neuropátiás fájdalom a központi szomatoszenzoros rendszert érintő sérülés vagy betegség közvetlen következményeként, valamint a központi idegrendszer spinothalamocorticalis pályáira kifejtett kóros hatások eredményeként jelentkezik.
A központi neuropátiás fájdalom leggyakoribb okai: ischaemiás és vérzéses stroke, sclerosis multiplex, gerincvelő-sérülés, érrendszeri rendellenességek, syringomyelia, az agy és a gerincvelő térfoglaló elváltozásai, epilepszia, fertőző agykárosodás (encephalitis). Az idegrendszer károsodásának nosológiai formái közül a neuropátiás fájdalom előfordulása agyi stroke esetén 8-10% (Yakhno N.N., Kukushkin M.L., Davydov O.S., 2008).
A központi stroke utáni fájdalom koncepcióját Edinger vetette fel először 1891-ben. 15 évvel később Dejerine és Roussy híres „Thalamikus szindróma” című művében leírták a központi agyvérzés utáni fájdalmat. Erős, perzisztens, paroxizmális, gyakran elviselhetetlen, hemiplegia oldalán jelentkezőként jellemezték, amelyben a fájdalomcsillapító kezelésnek nem volt hatása. A patomorfológiai vizsgálat 8 betegből 3-nál tárt fel elváltozásokat a thalamusban és a belső tok hátsó gumójában. Head és Holmes 1911-ben részletesen leírta 24 stroke-os beteg érzékenységének és fájdalomcsökkenését, melynek klinikai tünetei az optikai thalamus károsodására utaltak, és központi fájdalom kísérte. 1938-ban Riddoch leírta a thalamicus és extrathalamicus eredetű fájdalom klinikai megnyilvánulásait.
Kórélettani szempontból centrális neuropátiás fájdalom akkor jelentkezik, amikor a központi idegrendszer nociceptív struktúrák bevonásával sérül, ami a nociceptív neuronok változásához, valamint az antinociceptív leszálló hatások aktivitásának csökkenéséhez vezet. A centrális poszt-stroke fájdalom kialakulásának lehetséges mechanizmusa a nociceptív rendszer laterális és mediális része közötti funkcionális egyensúlyhiány, valamint a kérgi és talamikus struktúrák kontrolljának megsértése a bejövő fájdalominformációk felett. A CPIB előfordulhat az agy szomatoszenzoros pályáinak bármilyen szintű károsodásával, beleértve a medulla oblongata-t, a thalamust és az agykérget.
Így a következők fontos szerepet játszanak a központi stroke utáni fájdalom patofiziológiájában:
1. Központi szenzibilizáció, amely a krónikus fájdalom oka.
2. Zavar hiperingerlékenység és aktivitás formájában a spinothalamikus traktusban.
3. A laterális thalamus elváltozása, amely megszakítja a gátlási utakat és a mediális thalamus gátlását okozza (diszinhibíciós elmélet).
4. Változások a thalamusban, mivel fájdalomgenerátor szerepet tölt be, és a gátló GABA tartalmú neuronok elvesztése és a mikroglia aktiválódása következik be.
MacCoulan és munkatársai (1997) szerint a központi stroke utáni fájdalom előfordulása az agyi stroke helyétől függ. Általában a medulla oblongata laterális infarktusával (Wallenberg-szindróma) és a thalamus posteroventralis részének károsodásával fordul elő.
A thalamicus infarktust a tünetek hármasa jellemzi: anterográd amnézia, információ-érzékelési zavarok és térbeli zavarok. Szívroham során a paramedián thalamicus-subthalamicus artériák vérellátásának területén akut tudatzavar figyelhető meg. Hiperszomnia lehetséges: a betegek izgatottak, de a stimuláció megszűnése után hamarosan mély álomba merülhetnek. Apátiát, közömbösséget és motivációhiányt tapasztalnak. Oculomotor függőleges parézis észlelhető.
A paramediális thalamusban bekövetkező nagyméretű infarktus esetén afázia, átmeneti vagy tartós demencia társul. A paramediális thalamusban szimmetrikusan elhelyezkedő elváltozások gátlási szindrómát okoznak, beleértve a mániás delíriumot, az infantilitást vagy a Kluver-Bucy-szindrómát.
A CPIB klinikai képét az jellemzi, hogy közvetlenül a stroke után vagy néhány hónappal azután jelentkezik. A fájdalom a test jobb vagy bal oldalán jelentkezik, bár egyes betegeknél lokalizált lehet: az egyik karban, lábban vagy az arc területén. Krónikus, súlyos és tartós. Néha spontán fordul elő, vagy valamilyen irritáló hatás okozza. A betegek úgy jellemzik, hogy éget, fáj, fagy, szorít, szúr, lövöldöz, fájdalmas, legyengít. A CPIP kötelező tünete az érzékenység zavara: hőmérséklet, fájdalom, ritkábban tapintás vagy vibráció, például hypoesthesia vagy hyperesthesia. A fájdalom jelentősen befolyásolja a betegek életminőségét, megzavarja az alvást, és rontja a rehabilitáció hatékonyságát.
A neuropátiás fájdalomszindrómát specifikus szenzoros rendellenességek tünetegyüttese jellemzi, mint például az allodynia (a fájdalom megjelenése nem fájdalmas ingerre adott válaszként), a hiperalgézia. fokozott érzékenység fájdalmas ingerre), hyperesthesia (fokozott válasz tapintási ingerre), hypoesthesia (tapintási érzékenység elvesztése), hypalgésia (csökkent fájdalomérzékenység), zsibbadás érzése, kúszás.
A központi stroke utáni fájdalom diagnosztikai kritériumai között megkülönböztetik a kötelező és a kiegészítő kritériumokat.
A CPIP kötelező diagnosztikai kritériumai a következők:
1. A fájdalom lokalizációja a központi idegrendszeri elváltozás szerint.
2. Sztrókra utaló anamnézis és a fájdalom a szélütéssel egyidejűleg vagy később jelentkezett.
3. A központi idegrendszerben lévő kóros fókusz jelenlétének megerősítése képalkotáson vagy negatív vagy pozitív szenzoros tüneteken, amelyek az elváltozásnak megfelelő területre korlátozódnak.
4. A fájdalom egyéb okai, mint például a nociceptív vagy perifériás neuropátiás fájdalom, kizártak vagy valószínűtlennek tekinthetők.
Kiegészítő diagnosztikai kritériumok:
1. Nincs ok-okozati összefüggés mozgással, gyulladással vagy más típusú helyi szövetkárosodással.
2. A fájdalmas érzések égő, fájó, nyomó, bizsergő jellegűek. Rovarcsípéshez, áramütéshez vagy fájdalmas megfázáshoz hasonló fájdalom jelentkezhet.
3. Allodynia vagy dysesthesia jelenléte hidegnek vagy érintésnek kitéve.
A Klinikai Klinikai Gyakorlati Központ kritériumainak való megfelelés szempontjából a klinikai esetek értékelésére a következő rendszert alkalmazzuk:
1. A fájdalom egyéb lehetséges okainak kizárása. A fájdalomnak nincs más nyilvánvaló oka.
2. A fájdalomnak világos és anatómiai alapú lokalizációja van. Egyoldalúan lokalizálódik a központi idegrendszer léziójában a testen és/vagy az arcon, vagy egyoldalúan a testben, az arc ellenoldali érintettségével.
3. Sztrókra utaló anamnézis. A neurológiai tünetek hirtelen alakultak ki; a fájdalom a stroke-tal egyidejűleg vagy később jelentkezett.
4. Egyértelmű és anatómiailag megalapozott rendellenességek azonosítása klinikai neurológiai vizsgálat során. A páciens ezen vizsgálata során érzékenységi zavart (pozitív vagy negatív előjellel) észlelnek a fájdalmas területen. A fájdalom az érzékszervi zavarok területén lokalizálódik, és elhelyezkedése anatómiailag indokolható a lézió központi idegrendszeri lokalizációjával.
5. A megfelelő vaszkuláris elváltozás azonosítása neuroimaging módszerekkel. A CT vagy MRI elvégzésekor egy patológiás fókusz látható, amely megmagyarázhatja az érzékenységi rendellenességek helyét.
Így a CPIP diagnózisa a kórelőzményen és a klinikai neurológiai vizsgálat eredményein alapul. Figyelembe veszik a fájdalom kezdetére, annak természetére, a dysesthesia vagy allodynia jelenlétére és az érzékszervi zavarokra vonatkozó információkat. Vizuális analóg skálát használnak a fájdalom, valamint a neuroimaging adatok (CT vagy MRI az agyról) értékelésére.
Az Európai Neurológiai Társaságok Szövetségének a neuropátiás fájdalom-szindróma gyógyszeres kezeléséről szóló ajánlásai (2010) szerint a CPIP kezelésében a következő gyógyszercsoportokat alkalmazzák: antidepresszánsok, görcsoldók (Ca-csatorna agonisták - gabapentin, pregabalin; Na-csatorna-blokkolók) - karbamazepin), opioid fájdalomcsillapítók, helyi gyógyszerek (lidokain stb.), NMDA receptor antagonisták (ketamin, memantin, amantadin), valamint neurostimuláció.
A problémával foglalkozó orvosok széleskörű tapasztalatai, valamint a placebo-kontrollos vizsgálatok adatai alapján megállapították, hogy a CPIP kezelésében a leghatékonyabb megközelítés az antidepresszánsok felírása.
Az antidepresszánsok hatásmechanizmusa a monoaminok (szerotonin, noradrenalin) neuronális újrafelvételének blokkolása a központi idegrendszerbe. A legnagyobb fájdalomcsillapító hatást az amitriptilinnél figyelték meg. A duloxetin, a venlafaxin és a paroxetin kifejezett fájdalomcsillapító tulajdonságokkal rendelkezik. A fájdalomcsillapító hatás kialakulása fájdalomszindrómás betegek antidepresszánsokkal történő kezelésében az antinociceptív rendszer tónusos aktivitásának növekedésével jár, ami a nociceptív neuronok szerotonin és noradrenerg gátlása eredményeként következik be, a monoaminok preszinaptikus végződésekkel. Ez a mediátorok felhalmozódásához vezet a szinaptikus hasadékban, és növeli a monoaminerg szinaptikus átvitel hatékonyságát. A tényleges fájdalomcsillapító hatás mellett az antidepresszánsok erősítik a kábító fájdalomcsillapítók hatását, növelve az opioid receptorokhoz való affinitásukat.
17 vizsgálatban 10 antidepresszáns hatékonyságát és biztonságosságát vizsgálták a neuropátiás fájdalom szindróma kezelésében. Ezek a vizsgálatok azt találták, hogy nincs jelentős különbség a különböző hatásmechanizmusú antidepresszánsok hatékonyságában. A szerotonin- és noradrenalin-visszavétel-gátlók csoportjába tartozó venlafaxin és duloxetin hatékonynak bizonyult a diabéteszes polyneuropathia kezelésében. A trazodon (Trittico) 50-300 mg/nap dózisban számos tanulmány kimutatta, hogy hatékony a fájdalom kezelésében olyan állapotok esetén, mint a fibromyalgia (Molina-Barea R. et al., 2008), a diabéteszes neuropátia (Wilson R.C., 1999), migrénes fájdalom (Brewetton T.D. et al., 1988), krónikus fájdalom (Ventafridda V. és munkatársai, 1988, 1. ábra).
Így akár 225 mg/nap dózisban a Trittico fájdalomcsillapító hatásában nem volt rosszabb, mint az amitriptilin az onkológiai gyakorlatban a fájdalom kezelésében. A Trittico szedése ugyanakkor lényegesen rövidebb kórházi tartózkodást biztosított a súlyos daganatos betegeknek, lehetőséget biztosított az aktív, fájdalommentes életmódra. mellékhatások amelyek az amitriptilin szedésekor jelentkeznek (1. ábra).
A trazodon az amitriptilin modern alternatívája a krónikus fájdalom szindrómában szenvedő betegek komplex kezelésében.
A Neuropszichofarmakológiai Világkongresszus Tanácsa (Kanada, Montreal, 2002) a trazodont (Trittico) atípusos antidepresszánsként azonosította, amely túlnyomórészt nyugtató és szorongásoldó hatású, a 2-es típusú szerotonin receptor antagonisták és szerotonin újrafelvétel-gátlók (SARI) első és egyetlen képviselője. Ukrajnában. Farmakológiai paraméterei szerint a trazodon a szerotonin receptor antagonisták (5-HT) és a szelektív szerotonin újrafelvétel-gátlók (SSRI-k) csoportjába tartozik. A benne rejlő valamennyi gyógyszerhatás közül a szerotoninreceptorok blokkolása kifejezettebb, mint a szerotonin újrafelvétel gátlása. A trazodon (Trittico) antagonistaként hat a szerotonin 2A receptorokon és részleges agonistaként az 5-HT1A receptorokon. Ez határozza meg a depresszió, alvászavarok, szorongás és szexuális zavarok kezelésére való alkalmazását. A gyógyszer az alfa-1 adrenerg receptorokra is kifejezett hatással van, és kevésbé hatékonyan gátolja a szerotonin újrafelvételét (Stephen M., Stahl M., 2. ábra).

Így a trazodon a receptorprofilra kifejtett egyedülálló komplex multifunkcionális hatása miatt erőteljes antidepresszáns és szorongásoldó hatást biztosít az alvászavarok helyreállításával kombinálva, beleértve az SSRI-k által okozott alvászavarokat is.
A trazodon (Trittiko) erős antidepresszáns hatással rendelkezik, ami nagyon fontos a stroke utáni betegek számára. Különböző szerzők szerint a stroke utáni depresszió előfordulási gyakorisága 25 és 79% között mozog. Ezenkívül fontos megjegyezni, hogy kialakulása a stroke utáni korai és késői időszakban is lehetséges, bár a depressziós epizódok maximális gyakoriságát az ischaemiás stroke felépülési időszakában rögzítik.
A trazodont (Trittiko) a terápia első napjaitól kezdve kifejezett szorongásoldó hatás jellemzi. Egy 230 beteg bevonásával végzett kettős-vak, placebo-kontrollos, randomizált vizsgálatban a trazodon hatásosnak és jól tolerálhatónak bizonyult generalizált szorongásos zavarban. A betegeket 3 csoportra osztották. Az 1. csoport 143 mg/nap imipramint, a 2. csoport 225 mg/nap trazodont, a 3. csoport pedig 26 mg/nap diazepamot kapott. 8 hetes terápia után az imipramin csoportban a betegek 73%-a, a trazodon csoport 69%-a, a diazepam csoport 66%-a, és a placebót szedőknek csak 47%-a számolt be állapota mérsékelt vagy jelentős javulásáról (3. ábra). .

A tanulmány megerősítette, hogy a trazodon rendkívül hatékony és lényegesen jobban tolerálható, mint más gyógyszerek.
A Trittico hatékonynak bizonyult a frontotemporális demenciában szenvedő betegek kezelésében. A gyógyszer maximum 250 mg/nap dózisban történő alkalmazása (a dózistitrálás 50 mg-mal kezdődik) 9 héten keresztül a tünetek észrevehető javulásához vezet: csökken az izgatottság, az irritáció, a depresszió, és normalizálódik az étkezési viselkedés.
A Trittico gyógyszert kiváló tolerálhatóság jellemzi, összehasonlítható az SSRI-kkel, ami nagyon fontos a stroke-on átesett betegek számára, és biztosítja a terápia magas szintű betartását. A gyógyszer nem okoz antikolinerg hatásokat, izgatottságot, alvászavarokat, szexuális diszfunkciót, ortosztatikus hipotenziót, súlygyarapodást, EKG-változásokat vagy a vérlemezke-aggregáció gátlását. Kisebb gyomor-bélrendszeri zavarok léphetnek fel, mint például hányinger, hányás, hasmenés és lehetséges álmosság.
A Trittico adagolása a következőképpen történik. Az 1.-3. napon 50 mg-ot írnak fel lefekvés előtt (a tabletta 1/3-a), ami jobb alvást biztosít. A 4-6. napon az adag 100 mg lefekvés előtt (2/3 tabletta), ami szorongásoldó hatást vált ki. A 7. naptól a 14. napig az antidepresszáns hatás érdekében az adagot lefekvés előtt 150 mg-ra emelik (1 táblázat). És a 15. naptól az antidepresszáns hatás megszilárdítása érdekében az adagot 150 mg-on tartják, vagy 300 mg-ra emelik (2 táblázat).
Így a Trittico (trazodon) a SARI osztály első és egyetlen képviselője Ukrajnában, amely a legnagyobb globális bizonyítékokkal rendelkezik, és hatékony antidepresszánsként bizonyult a depresszió, szorongás, alvászavarok tüneteinek megszüntetésében, valamint krónikus fájdalom szindrómában szenvedő betegek kezelése.
Felkészítő: Tatyana Chistik