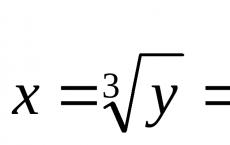Oksitlerin su ile reaksiyonu. Asit oksitlerin kimyasal özellikleri
|
Bir video dersi (kayıtlı web semineri, 1,5 saat) ve "Oksitler: hazırlanması ve kimyasal özellikleri" konulu bir teori seti satın alabilirsiniz. Malzemelerin maliyeti 500 ruble. Bağlantıdaki Yandex.Money sistemi (Visa, Mastercard, MIR, Maestro) aracılığıyla ödeme. Dikkat!Ödeme yapıldıktan sonra, web seminerini indirmek ve izlemek için bağlantı gönderebileceğiniz e-posta adresini belirten “Oxides” işaretli bir mesaj göndermelisiniz. Siparişin ödemesini yaptıktan ve mesajı aldıktan sonra 24 saat içinde web semineri materyalleri e-posta adresinize gönderilecektir. Mesaj aşağıdaki yollardan biriyle gönderilebilir:
Mesaj olmadan ödemeyi belirleyemeyiz ve size malzemeleri gönderemeyiz. |
Kimyasal özellikler bazik oksitler
Oksitlerle ilgili ayrıntılar, sınıflandırılması ve elde edilme yöntemleri okunabilir .
1. Su ile etkileşim. Yalnızca çözünebilir hidroksitlere (alkaliler) karşılık gelen bazik oksitler suyla reaksiyona girebilir. Alkaliler alkali metalleri (lityum, sodyum, potasyum, rubidyum ve sezyum) ve alkali toprak metallerini (kalsiyum, stronsiyum, baryum) oluşturur. Diğer metallerin oksitleri suyla kimyasal reaksiyona girmez. Magnezyum oksit kaynatıldığında suyla reaksiyona girer.
CaO + H 2 O → Ca(OH) 2
CuO + H 2 O ≠
2. Asit oksitler ve asitlerle etkileşim. Bazik oksitler asitlerle etkileşime girdiğinde bu asidin bir tuzu ve su oluşur. Bir bazik oksit ve bir asit reaksiyona girdiğinde bir tuz oluşur:
bazik oksit + asit = tuz + su
bazik oksit + asidik oksit = tuz
Bazik oksitler asitler ve bunların oksitleri ile etkileşime girdiğinde aşağıdaki kural uygulanır:
Reaktiflerden en az biri güçlü bir hidroksite (alkali veya güçlü asit) karşılık gelmelidir..
Yani alkalilere karşılık gelen bazik oksitler, tüm asidik oksitler ve bunların asitleriyle reaksiyona girer. Çözünmeyen hidroksitlere karşılık gelen bazik oksitler, yalnızca güçlü asitler ve bunların oksitleri (N205, NO2, SO3, vb.) ile reaksiyona girer.
3. Amfoterik oksitler ve hidroksitlerle etkileşim.
Bazik oksitler amfoterik olanlarla etkileşime girdiğinde tuzlar oluşur:
bazik oksit + amfoterik oksit = tuz
Füzyon sırasında amfoterik oksitlerle etkileşime girerler. yalnızca alkalilere karşılık gelen bazik oksitler . Bu tuz oluşturur. Tuzdaki metal daha bazik oksitten, asit kalıntısı ise daha asidik olandan gelir. Bu durumda amfoterik oksit bir asit kalıntısı oluşturur.
K 2 Ö + Al 2 Ö 3 → 2KAlO 2
CuO + Al 2 Ö 3 ≠ (Cu(OH)2 çözünmeyen bir hidroksit olduğundan reaksiyon gerçekleşmez)
(asit kalıntısını belirlemek için amfoterik veya asidik oksit formülüne bir su molekülü ekleriz: Al 2 O 3 + H 2 O = H 2 Al 2 O 4 ve oksidasyon durumu varsa elde edilen endeksleri ikiye böleriz. element tektir: HAlO 2. Sonuç bir alüminat iyonu AlO 2'dir - İyonun yükü, bağlı hidrojen atomlarının sayısına göre kolayca belirlenebilir - eğer 1 hidrojen atomu varsa, anyonun yükü -1 olacaktır. , eğer 2 hidrojen varsa, o zaman -2 vb.).
Amfoterik hidroksitler ısıtıldığında ayrışır, dolayısıyla bazik oksitlerle reaksiyona giremezler.
4. Bazik oksitlerin indirgeyici maddelerle etkileşimi.
Bu nedenle bazı metal iyonları oksitleyici ajanlardır (voltaj serisinde ne kadar sağa doğru olursa o kadar güçlü olur). İndirgeyici maddelerle etkileşime girdiğinde metaller 0 oksidasyon durumuna girer.
4.1. Kömür veya karbon monoksit ile azaltma.
Karbon (kömür), yalnızca alüminyumdan sonra aktivite serisinde yer alan metalleri oksitlerden azaltır. Reaksiyon yalnızca ısıtıldığında meydana gelir.
FeO + C → Fe + CO

Karbon monoksit ayrıca elektrokimyasal seride yalnızca alüminyumdan sonra bulunan metalleri oksitlerden azaltır:
Fe203 + CO → Al203 + CO2
CuO + CO → Cu + CO2

4.2. Hidrojen ile indirgeme .
Hidrojen, oksitlerden yalnızca alüminyumun sağındaki aktivite serisinde yer alan metalleri azaltır. Hidrojenle reaksiyon yalnızca zorlu koşullar altında - basınç ve ısıtma altında gerçekleşir.
CuO + H 2 → Cu + H 2 O

4.3. Daha aktif metallerle indirgeme (metale bağlı olarak eriyik veya çözelti halinde)
Bu durumda daha aktif metaller daha az aktif olanların yerini alır. Yani okside eklenen metal, aktivite serisinde oksitten gelen metale göre solda yer almalıdır. Reaksiyonlar genellikle ısıtıldığında meydana gelir.
Örneğin , çinko oksit alüminyum ile etkileşime girer:
3ZnO + 2Al → Al 2 Ö 3 + 3Zn
ancak bakırla etkileşime girmez:
ZnO + Cu ≠
Diğer metalleri kullanarak metallerin oksitlerden indirgenmesi çok yaygın bir işlemdir. Genellikle metalleri restore etmek için alüminyum ve magnezyum kullanılır. Ancak alkali metaller bunun için pek uygun değildir - kimyasal olarak çok aktiftirler, bu da onlarla çalışırken zorluklar yaratır.
Örneğin sezyum havada patlar.
Alümotermi– metallerin oksitlerden alüminyumla indirgenmesidir.
Örneğin : alüminyum oksitten bakır(II) oksidi azaltır:
3CuO + 2Al → Al 2 Ö 3 + 3Cu
Magnietermi– metallerin oksitlerden magnezyumla indirgenmesidir.
CuO + H 2 → Cu + H 2 O

4.4. Amonyakla indirgeme.
Amonyakla yalnızca aktif olmayan metallerin oksitleri indirgenebilir. Reaksiyon yalnızca yüksek sıcaklıklarda meydana gelir.
Örneğin , amonyak bakır(II) oksidi azaltır:
3CuO + 2NH3 → 3Cu + 3H2 Ö + N2
5. Bazik oksitlerin oksitleyici maddelerle etkileşimi.
Oksitleyici ajanların etkisi altında, bazı bazik oksitler (metallerin oksidasyon durumunu artırabildiği, örneğin Fe 2+, Cr 2+, Mn 2+, vb.) indirgeyici ajan olarak görev yapabilir.
Örneğin ,Demir(II) oksit, oksijenle demir(III) okside oksitlenebilir:
4FeO + Ö2 → 2Fe2Ö3
Suyun kimyasal özellikleri
Suyun metallerle etkileşimi.
Kalsiyum talaşları bir su silindirine konursa, tıpkı bir sülfürik asit çözeltisine yerleştirilen çinko yüzeyinde olduğu gibi, kalsiyum yüzeyinden gaz kabarcıkları kopmaya başlayacaktır. Silindirdeki deliğe yanan bir kıymık getirdiğimizde parlamalar gözlemleyeceğiz. Bu hidrojen yanmasıdır. Silindirdeki su bulanıklaşır. Silindirde görünen beyaz asılı parçacıklar kalsiyum hidroksit Ca (OH) 2'dir. Devam eden reaksiyon aşağıdaki denklemle ifade edilir:
Ca + 2H 2 0 = 2Ca (OH) 2 + H 2
Bu reaksiyon sırasında, H-OH (grup - OH - hidrokso grubu) olarak temsil edilebilen bir su molekülü H20'dan -OH, kalsiyum hidroksite dönüştürülür. Kalsiyum atomu iki değerlikli olduğundan iki su molekülünden iki hidrojen atomunu çıkarır ve geri kalan iki -OH grubu kalsiyum atomuyla birleşir.
Sodyumun su ile reaksiyonu daha da kuvvetli bir şekilde ilerler. Bir bardak suya bir parça sodyum koyun. Sodyum yüzeye doğru yüzer, erir ve parlak bir damlaya dönüşür. Suyun yüzeyi boyunca hızla hareket eder, tıslama yayar ve boyutu küçülür. Çözeltiyi buharlaştırdıktan sonra beyaz bir katı madde bulacağız - sodyum hidroksit NaOH
2Na + 2НН = 2NaOH + H2
Sodyum ve kalsiyum kimyasal olarak en aktif olanlardır.
Suyun metal olmayan oksitlerle etkileşimi .
Kavanozun içindeki kırmızı fosforu kaşıkla yakalım. Biraz su ekleyelim ve ortaya çıkan fosfor oksit (V) P 2 0 5 çözülene kadar bekleyelim. Çözeltiye birkaç damla mor turnusol ekleyin. Turnusol kırmızıya dönecek. Bu, çözeltinin bir asit içerdiği anlamına gelir Fosfor oksit (V) suyla birleşir ve fosforik asit H3P0 4 elde edilir:
Р 2 0 5 + ЗН 2 0 = 2Н 3 Р0 4
İçinde biraz su bulunan bir kavanozda kükürtü yakalım ve ortaya çıkan çözeltiyi turnusol çözeltisiyle inceleyelim. Ayrıca kırmızıya dönecek. Sülfürün yanması sırasında oluşan kükürt oksit (IV) S0 2, suyla birleştirildi ve sülfürik asit elde edildi:
S0 2 + H 2 0 = H 2 S0 2
Su ile etkileşime giren kükürt oksit (VI), sülfürik asit H2S04'ü oluşturur:
SO2+ H 2 Ö = H 2 S0 4
Azot, suyla reaksiyona girerek nitrik asit oluşturan N205 oksit oluşturabilir:
N 2 0 5 + N 2 0 = 2HN0 3
Metal olmayan oksitlerin su ile olan bileşikleri asitler olarak sınıflandırılır.
Suyun metal oksitlerle etkileşimi.
 Şimdi metal oksitlerin su ile ilişkisini ele alalım. Bakır oksit CuO, demir oksit Fe203, çinko oksit ZnO ve kalsiyum oksit CaO'yu kaplara dökün ve her birine bir miktar su ekleyin. Bakır, demir ve çinko oksitleri suda çözünmez ve onunla birleşmez. Kalsiyum oksit veya sönmemiş kireç farklı davranır.
Şimdi metal oksitlerin su ile ilişkisini ele alalım. Bakır oksit CuO, demir oksit Fe203, çinko oksit ZnO ve kalsiyum oksit CaO'yu kaplara dökün ve her birine bir miktar su ekleyin. Bakır, demir ve çinko oksitleri suda çözünmez ve onunla birleşmez. Kalsiyum oksit veya sönmemiş kireç farklı davranır.
Sönmemiş kireç parçalarının üzerine su dökülürken, o kadar güçlü bir ısınma gözlenir ki, suyun bir kısmı buhara dönüşür ve sönmemiş kireç parçaları ufalanır, kuru, gevşek toz - sönmüş kireç veya kalsiyum hidroksite dönüşürCa(OH) 2:
CaO + H20 = Ca(OH)2
Kalsiyum oksit gibi, sodyum ve potasyum oksitler de suyla birleşir:
Na 2 0 + H 2 0 = 2NaOH
K 2 0+N 2 0 = 2KON
Bu reaksiyonlar sodyum hidroksit NaOH ve potasyum hidroksit KOH üretir.
Bu nedenle, bazı metal oksitler suyla reaksiyona girmez (çoğunlukla), diğerleri (potasyum oksit, sodyum oksit, kalsiyum oksit, baryum oksit vb.) suyla birleşerek bazlar olarak sınıflandırılan hidroksitleri oluşturur.
(İnorganik kimya 7-8. Sınıf yazar Yu.V. Khodakov ve diğerleri)
Oksitler- bunlar, biri oksijen olan (oksidasyon durumunda -2) iki elementten oluşan karmaşık inorganik bileşiklerdir.
Örneğin Na 2 O, B 2 O 3, Cl 2 O 7 oksitler olarak sınıflandırılır. Bu maddelerin tümü oksijen ve bir element daha içerir. Na 2 O 2 , H 2 SO 4 ve HCl maddeleri oksit değildir: birincisinde oksijenin oksidasyon durumu -1'dir, ikincisinde iki değil üç element vardır ve üçüncüsü oksijen içermez hiç de.
Yükseltgenme numarası teriminin anlamını anlamıyorsanız sorun değil. Öncelikle bu sitedeki ilgili makaleye başvurabilirsiniz. İkincisi, bu terimi anlamasanız bile okumaya devam edebilirsiniz. Oksidasyon durumundan bahsetmeyi geçici olarak unutabilirsiniz.
Bazı soy gazlar ve "egzotik" transuranyum elementleri dışında, şu anda bilinen hemen hemen tüm elementlerin oksitleri elde edilmiştir. Üstelik birçok element birkaç oksit oluşturur (örneğin nitrojen için altısı bilinmektedir).
Oksitlerin isimlendirilmesi
Oksitleri isimlendirmeyi öğrenmeliyiz. Çok basit.örnek 1. Aşağıdaki bileşikleri adlandırın: Li 2 O, Al 2 O 3, N 2 O 5, N 2 O 3.
Li 2 O - lityum oksit,
Al 2 O 3 - alüminyum oksit,
N 2 O 5 - nitrik oksit (V),
N203 - nitrik oksit (III).
Lütfen önemli bir noktaya dikkat edin: Bir elementin değerliği sabitse, oksit adına bundan söz etmeyiz. Değer değişirse, bunu parantez içinde belirttiğinizden emin olun! Lityum ve alüminyum var sabit değerlik nitrojenin değişken bir değeri vardır; Bu nedenle nitrojen oksitlerin adlarına değerliliği simgeleyen Romen rakamları eklenmiştir.
1. Egzersiz. Oksitleri adlandırın: Na 2 O, P 2 O 3, BaO, V 2 O 5, Fe 2 O 3, GeO 2, Rb 2 O. Hem sabit hem de değişken değerliğe sahip elementlerin olduğunu unutmayın.
Bir diğer önemli nokta: F 2 O maddesini "flor oksit" değil, "oksijen florür" olarak adlandırmak daha doğrudur!
Oksitlerin fiziksel özellikleri
Fiziksel özellikler çok çeşitlidir. Bunun nedeni özellikle oksitlerin sergileyebilmesidir. farklı şekiller Kimyasal bağ. Erime ve kaynama noktaları büyük ölçüde değişir. Normal koşullar altında oksitler katı halde (CaO, Fe 2 O 3, SiO 2, B 2 O 3), sıvı halde (N 2 O 3, H 2 O), gaz formunda (N 2 O) olabilir. , SO 2, NO, CO).
Çeşitli renkler: MgO ve Na 2 O beyaz, CuO siyah, N 2 O 3 mavi, CrO 3 kırmızı vb.
İyonik tipte bir bağa sahip oksitlerin eriyikleri elektriği iyi iletir; kovalent oksitler kural olarak düşük elektrik iletkenliğine sahiptir.
Oksitler sınıflandırması
Doğada bulunan tüm oksitler 4 sınıfa ayrılabilir: bazik, asidik, amfoterik ve tuz oluşturmayan. Bazen ilk üç sınıf tuz oluşturan oksitler grubunda birleştirilir, ancak bu bizim için artık önemli değil. Farklı sınıflara ait oksitlerin kimyasal özellikleri büyük ölçüde farklılık gösterir, bu nedenle sınıflandırma konusu, bu konunun daha ileri düzeyde incelenmesi için çok önemlidir!
İle başlayalım tuz oluşturmayan oksitler. Unutulmaması gerekenler: NO, SiO, CO, N 2 O. Sadece bu dört formülü öğrenin!
İlerlemek için doğada iki türün olduğunu hatırlamalıyız. basit maddeler- metaller ve ametaller (bazen başka bir yarı metal veya metaloid grubu ayırt edilir). Hangi elementlerin metal olduğu konusunda net bir anlayışa sahipseniz bu makaleyi okumaya devam edin. En ufak bir şüpheniz varsa materyale bakın "Metaller ve metal olmayanlar" bu web sitesinde.
Yani size tüm amfoterik oksitlerin metal oksit olduğunu ancak tüm metal oksitlerin amfoterik olmadığını söyleyeyim. Bunlardan en önemlilerini sıralayacağım: BeO, ZnO, Al 2 O 3, Cr 2 O 3, SnO. Liste tam değil ama listelenen formülleri mutlaka hatırlamalısınız! Çoğu amfoterik oksitte metal +2 veya +3 oksidasyon durumu sergiler (ancak istisnalar da vardır).
Yazının bundan sonraki bölümünde sınıflandırmadan bahsetmeye devam edeceğiz; Asidik ve bazik oksitleri tartışalım.
Oksitler iki bileşikten oluşan inorganik bileşiklerdir. kimyasal elementler Bunlardan biri -2 oksidasyon durumundaki oksijendir. Tek bir oksit oluşturmayan bir element flordur oksijenle birleşerek oksijen florür oluşturur. Bunun nedeni florun oksijenden daha elektronegatif bir element olmasıdır.
Bu bileşik sınıfı çok yaygındır. Bir kişi günlük yaşamda her gün çeşitli oksitlerle karşılaşır. Su, kum, soluduğumuz karbondioksit, araba egzozu, pas, hepsi oksit örnekleridir.
Oksitler sınıflandırması
Tüm oksitler tuz oluşturma yeteneklerine göre iki gruba ayrılabilir:
- Tuz oluşturan oksitler (CO 2, N 2 O 5, Na 2 O, SO 3, vb.)
- Tuz oluşturmayan oksitler (CO, N2O, SiO, NO, vb.)
Buna karşılık, tuz oluşturan oksitler 3 gruba ayrılır:
- Bazik oksitler- (Metal oksitler - Na20, CaO, CuO, vb.)
- Asidik oksitler - (Metal olmayan oksitlerin yanı sıra metal oksitler de oksidasyon V-VII- Mn 2 O 7, CO 2, N 2 O 5, SO 2, SO 3, vb.)
- (Oksidasyon durumu III-IV olan metal oksitlerin yanı sıra ZnO, BeO, SnO, PbO)
Bu sınıflandırma, belirli kimyasal özelliklerin oksitler tarafından ortaya konulmasına dayanmaktadır. Bu yüzden, bazik oksitler bazlara, asidik oksitler asitlere karşılık gelir. Asidik oksitler, sanki bu oksitlere karşılık gelen baz ve asit reaksiyona girmiş gibi, karşılık gelen tuzu oluşturmak için bazik oksitlerle reaksiyona girer:  Aynı şekilde, amfoterik oksitler amfoterik bazlara karşılık gelir hem asidik hem de bazik özellikler sergileyebilen:
Aynı şekilde, amfoterik oksitler amfoterik bazlara karşılık gelir hem asidik hem de bazik özellikler sergileyebilen:  Farklı derecelerde oksidasyon sergileyen kimyasal elementler çeşitli oksitler oluşturabilir. Bu tür elementlerin oksitlerini bir şekilde ayırt etmek için, oksit adından sonra değer parantez içinde gösterilir.
Farklı derecelerde oksidasyon sergileyen kimyasal elementler çeşitli oksitler oluşturabilir. Bu tür elementlerin oksitlerini bir şekilde ayırt etmek için, oksit adından sonra değer parantez içinde gösterilir.
CO 2 – karbon monoksit (IV)
N 2 O 3 - nitrik oksit (III)
Oksitlerin fiziksel özellikleri
Oksitler çok çeşitlidir fiziki ozellikleri. Sıvılar (H 2 O), gazlar (CO 2, SO 3) veya katılar (Al 2 O 3, Fe 2 O 3) olabilirler. Ayrıca bazik oksitler genellikle katıdır. Oksitler ayrıca renksizden (H2O, CO) ve beyazdan (ZnO, TiO2) yeşile (Cr203) ve hatta siyaha (CuO) kadar çok çeşitli renklere sahiptir.
Bazik oksitler
Bazı oksitler su ile reaksiyona girerek karşılık gelen hidroksitleri (bazlar) oluşturur: Bazik oksitler asidik oksitlerle reaksiyona girerek tuz oluşturur: Asitlerle benzer şekilde reaksiyona girerler, ancak su açığa çıkar: Alüminyumdan daha az aktif metal oksitleri metallere indirgenebilir:
Asidik oksitler
Asidik oksitler suyla reaksiyona girerek asit oluşturur: Bazı oksitler (örneğin silikon oksit SiO2) suyla reaksiyona girmez, dolayısıyla asitler başka yollarla elde edilir.
Asidik oksitler bazik oksitlerle etkileşime girerek tuzlar oluşturur: Aynı şekilde, tuzların oluşumu sırasında asidik oksitler bazlarla reaksiyona girer: Bir polibazik asit belirli bir okside karşılık geliyorsa, o zaman bir asidik tuz da oluşabilir: Uçucu olmayan asit oksitler tuzlardaki uçucu oksitlerin yerini alabilir:
Daha önce de belirtildiği gibi amfoterik oksitler koşullara bağlı olarak hem asidik hem de bazik özellikler sergileyebilir. Böylece asitler veya asidik oksitlerle reaksiyonlarda bazik oksitler gibi davranarak tuzlar oluştururlar: Bazlar veya bazik oksitlerle reaksiyonlarda ise asidik özellikler gösterirler: 
Oksitlerin elde edilmesi
Oksitler çeşitli şekillerde elde edilebilir, ana olanları sunacağız.
Çoğu oksit, oksijenin bir kimyasal elementle doğrudan etkileşimi yoluyla elde edilebilir:  Çeşitli ikili bileşikleri kavururken veya yakarken: Tuzların, asitlerin ve bazların termal ayrışması:
Çeşitli ikili bileşikleri kavururken veya yakarken: Tuzların, asitlerin ve bazların termal ayrışması:  Bazı metallerin su ile etkileşimi:
Bazı metallerin su ile etkileşimi:
Oksitlerin uygulanması
 Oksitler her yerde oldukça yaygındır. dünyaya hem günlük yaşamda hem de endüstride kullanılmaktadır. En önemli oksit olan hidrojen oksit, su, Dünya'da yaşamı mümkün kıldı. Sülfür oksit SO3, sülfürik asit üretmek ve ayrıca gıda ürünlerini işlemek için kullanılır - bu, örneğin meyvelerin raf ömrünü uzatır.
Oksitler her yerde oldukça yaygındır. dünyaya hem günlük yaşamda hem de endüstride kullanılmaktadır. En önemli oksit olan hidrojen oksit, su, Dünya'da yaşamı mümkün kıldı. Sülfür oksit SO3, sülfürik asit üretmek ve ayrıca gıda ürünlerini işlemek için kullanılır - bu, örneğin meyvelerin raf ömrünü uzatır.
Demir oksitler boya elde etmek ve elektrot üretmek için kullanılır, ancak çoğu demir oksit metalurjide metalik demire indirgenir.
Sönmemiş kireç olarak da bilinen kalsiyum oksit inşaatlarda kullanılır. Çinko ve titanyum oksitler Beyaz renk ve suda çözünmezler, bu nedenle boya üretimi - badana için iyi bir malzeme haline gelmişlerdir.
Silikon oksit SiO 2 camın ana bileşenidir. Krom oksit Cr2O3, renkli yeşil cam ve seramik üretiminde ve yüksek mukavemet özelliklerinden dolayı ürünlerin parlatılmasında (GOI macunu formunda) kullanılır.
Tüm canlı organizmalar tarafından nefes alırken salınan karbon monoksit CO 2, yangın söndürmede ve ayrıca kuru buz şeklinde bir şeyi soğutmak için kullanılır.
Oksitler, biri oksidasyon durumuna ($-2$) sahip oksijen olan iki kimyasal elementten oluşan karmaşık maddelerdir.
Oksitlerin genel formülü şöyledir: $E_(m)O_n$, burada $m$, $E$ elementinin atom sayısıdır ve $n$, oksijen atomlarının sayısıdır. Oksitler olabilir zor(kum $SiO_2$, kuvars çeşitleri), sıvı(hidrojen oksit $H_2O$), gazlı(karbon oksitler: karbondioksit $CO_2$ ve karbondioksit $CO$ gazları). Kimyasal özelliklerine göre oksitler tuz oluşturan ve tuz oluşturmayan olarak ikiye ayrılır.
Tuz oluşturmayan Bunlar alkaliler veya asitlerle reaksiyona girmeyen ve tuz oluşturmayan oksitlerdir. Bunlardan çok azı var, metal olmayanlar içeriyorlar.
Tuz oluşturan Bunlar asitler veya bazlarla reaksiyona girerek tuz ve su oluşturan oksitlerdir.
Tuz oluşturan oksitler arasında oksitler vardır bazik, asidik, amfoterik.
Bazik oksitler- bunlar bazlara karşılık gelen oksitlerdir. Örneğin: $CaO$ $Ca(OH)_2'ye, Na_2O ise NaOH$'a karşılık gelir.
Bazik oksitlerin tipik reaksiyonları:
1. Bazik oksit + asit → tuz + su (değişim reaksiyonu):
$CaO+2HNO_3=Ca(NO_3)_2+H_2O$.
2. Bazik oksit + asidik oksit → tuz (bileşik reaksiyonu):
$MgO+SiO_2(→)↖(t)MgSiO_3$.
3. Bazik oksit + su → alkali (bileşik reaksiyonu):
$K_2O+H_2O=2KOH$.
Asidik oksitler- bunlar asitlere karşılık gelen oksitlerdir. Bunlar metal olmayan oksitlerdir:
N2O5, $HNO_3, SO_3 - H_2SO_4, CO_2 - H_2CO_3, P_2O_5 - H_3PO_4$'a ve ayrıca yüksek oksidasyon durumlarına sahip metal oksitlere karşılık gelir: $(Cr)↖(+6)O_3$, $H_2CrO_4, (Mn_2)↖('ye karşılık gelir +7 )O_7 — HMnO_4$.
Asidik oksitlerin tipik reaksiyonları:
1. Asit oksit + baz → tuz + su (değişim reaksiyonu):
$SO_2+2NaOH=Na_2SO_3+H_2O$.
2. Asit oksit + bazik oksit → tuz (bileşik reaksiyonu):
$CaO+CO_2=CaCO_3$.
3. Asit oksit + su → asit (bileşik reaksiyonu):
$N_2O_5+H_2O=2HNO_3$.
Bu reaksiyon ancak asit oksidin suda çözünmesi durumunda mümkündür.
Amfoterik Koşullara bağlı olarak bazik veya asidik özellikler sergileyen oksitlere denir. Bunlar $ZnO, Al_2O_3, Cr_2O_3, V_2O_5$'dır. Amfoterik oksitler suyla doğrudan birleşmezler.
Amfoterik oksitlerin tipik reaksiyonları:
1. Amfoterik oksit + asit → tuz + su (değişim reaksiyonu):
$ZnO+2HCl=ZnCl_2+H_2O$.
2. Amfoterik oksit + baz → tuz + su veya kompleks bileşik:
$Al_2O_3+2NaOH+3H_2O(=2Na,)↙(\text"sodyum tetrahidroksoalüminat")$
$Al_2O_3+2NaOH=(2NaAlO_2)↙(\text"sodyum alüminat")+H_2O$.