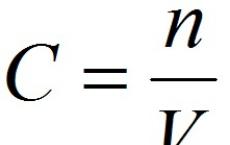Možna oksidacijska stanja mangana. Manganove(VII) spojine
Elektronska konfiguracija nevzbujenega atoma mangana je 3d 5 4s 2; vzbujeno stanje je izraženo z elektronsko formulo 3d 5 4s 1 4p 1.
Najbolj značilna oksidacijska stanja za mangan v spojinah so +2, +4, +6, +7.
Mangan je srebrno bela, krhka, dokaj aktivna kovina: v območju napetosti je med aluminijem in cinkom. Na zraku je mangan prekrit z oksidnim filmom, ki ga ščiti pred nadaljnjo oksidacijo. V fino zdrobljenem stanju mangan zlahka oksidira.
Manganov (II) oksid MnO in njegov ustrezen hidroksid Mn(OH) 2 imata bazične lastnosti - pri interakciji s kislinami nastanejo dvovalentne manganove soli: Mn(OH) 2 + 2 H + ® Mn 2+ + 2 H 2 O.
Kationi Mn 2+ nastajajo tudi pri raztapljanju kovinskega mangana v kislinah. Manganove (II) spojine kažejo redukcijske lastnosti, na primer bela oborina Mn (OH) 2 hitro potemni na zraku, postopoma oksidira v MnO 2: 2 Mn (OH) 2 + O 2 ® 2 MnO 2 + 2 H 2 O .
Manganov (IV) oksid MnO 2 je najstabilnejša manganova spojina; zlahka se tvori tako med oksidacijo manganovih spojin v nižjem oksidacijskem stanju (+2) kot med redukcijo manganovih spojin v višjem visoke stopnje oksidacija (+6, +7):
Mn(OH) 2 + H 2 O 2 ® MnO 2 + 2 H 2 O;
2 KMnO 4 + 3 Na 2 SO 3 + H 2 O ® 2 MnO 2 ¯ + 3 Na 2 SO 4 + 2 KOH.
MnO 2 je amfoteren oksid, vendar so njegove kisle in bazične lastnosti šibko izražene. Eden od razlogov, da MnO 2 ne kaže jasno definiranih bazičnih lastnosti, je njegova močna oksidacijska aktivnost v kislem okolju ( = +1,23 V): MnO 2 se reducira v ione Mn 2+, namesto da tvori stabilne soli štirivalentnega mangana. Hidratno obliko, ki ustreza manganovemu (IV) oksidu, je treba obravnavati kot hidratiran manganov dioksid MnO 2 × xH 2 O. Manganov (IV) oksid kot amfoterni oksid formalno ustreza orto- in meta-oblikam kalijevega permanganatne kisline, ki ni izolirana v prosto stanje: H 4 MnO 4 – orto oblika in H 2 MnO 3 – meta oblika. Znan je manganov oksid Mn 3 O 4, ki ga lahko obravnavamo kot dvovalentno manganovo sol orto-oblike permanganove kisline Mn 2 MnO 4 - manganov (II) ortomanganit. V literaturi obstajajo poročila o obstoju Mn 2 O 3 oksida. Obstoj tega oksida je mogoče pojasniti, če ga obravnavamo kot dvovalentno manganovo sol meta-oblike permanganove kisline: MnMnO 3 - manganov (II) metamanganit.
Ko se manganov dioksid stopi v alkalnem mediju z oksidanti, kot sta kalijev klorat ali nitrat, se štirivalentni mangan oksidira v šestvalentno stanje in nastane kalijev manganat - sol, ki je zelo nestabilna tudi v raztopini permanganove kisline H 2 MnO 4, katerega anhidrid (MnO 3) ni znan:
MnO 2 + KNO 3 + 2 KOH ® K 2 MnO 4 + KNO 2 + H 2 O.
Manganati so nestabilni in nagnjeni k disproporcioniranju po reverzibilni reakciji: 3 K 2 MnO 4 + 2 H 2 O ⇆ 2 KMnO 4 + MnO 2 ¯ + 4 KOH,
Zaradi tega se zelena barva raztopine, ki jo povzročajo manganatni ioni MnO 4 2–, spremeni v vijolično barvo, značilno za permanganatne ione MnO 4 – .
Najbolj razširjena spojina sedemvalentnega mangana je kalijev permanganat KMnO 4 - sol, ki je znana le v raztopini permanganske kisline HMnO 4. Kalijev permanganat lahko dobimo z oksidacijo manganatov z močnimi oksidanti, na primer s klorom:
2 K 2 MnO 4 + Cl 2 ® 2 KMnO 4 + 2 KCl.
Manganov (VII) oksid ali manganov anhidrid Mn 2 O 7 je eksplozivna tekočina zeleno-rjave barve. Mn 2 O 7 lahko dobimo z reakcijo:
2 KMnO 4 + 2 H 2 SO 4 (konc.) ® Mn 2 O 7 + 2 KHSO 4 + H 2 O.
Manganove spojine v najvišji oksidacijski stopnji +7, zlasti permanganati, so močni oksidanti. Globina redukcije permanganatnih ionov in njihova oksidativna aktivnost je odvisna od pH medija.
V močno kislem okolju je produkt redukcije permanganata ion Mn 2+, kar povzroči dvovalentne manganove soli:
MnO 4 – + 8 H + + 5 e – ® Mn 2+ + 4 H 2 O ( = +1,51 V).
V nevtralnem, rahlo alkalnem ali rahlo kislem okolju MnO 2 nastane kot posledica redukcije permanganatnih ionov:
MnO 4 – + 2 H 2 O + 3 e – ® MnO 2 ¯ + 4 OH – ( = +0,60 V).
MnO 4 – + 4 H + + 3 e – ® MnO 2 ¯ + 2 H 2 O ( = +1,69 V).
V močno alkalnem okolju se permanganatni ioni reducirajo v manganatne ione MnO 4 2– in nastanejo soli, kot sta K 2 MnO 4 in Na 2 MnO 4:
MnO 4 – + e – ® MnO 4 2– ( = +0,56 V).
Olimpijske naloge iz kemije
(1 šolska stopnja)
1. Test
1. Mangan ima najvišjo stopnjo oksidacije v spojini
2. Reakcija nevtralizacije ustreza skrajšani ionski enačbi
1) H + + OH - = H 2 O
2) 2H + + CO 3 2- = H 2 O + CO 2
3) CaO + 2H + = Ca 2+ + H 2 O
4) Zn + 2H + = Zn 2+ + H 2
3. Interakcija drug z drugim
2) MnO in Na 2 O
3) P 2 O 5 in SO 3
4. Enačba za redoks reakcijo je
1) KOH + HNO 3 = KNO 3 + H 2 O
2) N 2 O 5 + H 2 O = 2 HNO 3
3) 2N 2 O = 2N 2 + O 2
4) BaCO 3 = BaO + CO 2
5. Reakcija izmenjave je interakcija
1) kalcijev oksid z dušikovo kislino
2) ogljikov monoksid s kisikom
3) etilen s kisikom
4) klorovodikova kislina z magnezijem
6. Kisli dež nastane zaradi prisotnosti v ozračju
1) dušikovi in žveplovi oksidi
4) zemeljski plin
7. Metan se poleg bencina in dizelskega goriva uporablja kot gorivo v motorjih z notranjim zgorevanjem (vozilih). Termokemična enačba za izgorevanje plina metana je:
CH 4 + 2O 2 = CO 2 + 2H 2 O + 880 kJ
Kolikšna količina kJ toplote se bo sprostila pri zgorevanju CH 4 s prostornino 112 litrov (pri nič)?
Izberi pravilen odgovor:
2. Cilji
1. V enačbi redoks reakcije razporedite koeficiente na kakršen koli vam znan način.
SnSO 4 + KMnO 4 + H 2 SO 4 = Sn(SO 4) 2 + MnSO 4 + K 2 SO 4 + H 2 O
Navedi imena oksidanta in reducenta ter oksidativno stanje elementov. (4 točke)
2. Zapišite reakcijske enačbe, ki omogočajo naslednje transformacije:
(2) (3) (4) (5)
CO 2 → Ca(HCO 3) 2 → CaCO 3 → CaO → CaCl 2 → CaCO 3
(5 točk)
3. Določite formulo alkadiena, če je njegova relativna gostota v zraku 1,862 (3 točke)
4. Leta 1928 je ameriški kemik iz korporacije General Motors Research, Thomas Midgley Jr., v svojem laboratoriju uspel sintetizirati in izolirati kemično spojino, sestavljeno iz 23,53% ogljika, 1,96% vodika in 74,51% fluora. Nastali plin je bil 3,52-krat težji od zraka in ni zgorel. Izpeljite formulo spojine, zapišite strukturne formule organskih snovi, ki ustrezajo dobljeni molekulski formuli, in jih poimenujte. (6 točk).
5. Zmešajte 140 g 0,5 % raztopine klorovodikove kisline z 200 g 3 % raztopine klorovodikove kisline. Kolikšen je odstotek klorovodikove kisline v novo dobljeni raztopini? (3 točke)
3. Križanka
Rešite besede, šifrirane v križanki
Oznake: 1→ - vodoravno
1↓ - navpično
↓ Produkt korozije železa.
→ Nastane z interakcijo (6) z glavnim oksidom.
→ Enota za količino toplote.
→ Pozitivno nabit ion.
→ Italijanski znanstvenik, po katerem je poimenovana ena najpomembnejših konstantnih količin.
→ Število elektronov v zunanjem nivoju elementa št. 14.
→……plin – ogljikov monoksid (IV).
→ Veliki ruski znanstvenik, znan med drugim kot ustvarjalec mozaičnih slik in avtor epigrafa.
→ Vrsta reakcije med raztopinama natrijevega hidroksida in žveplove kisline.
Navedite primer reakcijske enačbe za (1→).
Navedite konstanto, navedeno v (4).
Zapišite reakcijsko enačbo (8).
Napišite elektronsko strukturo atom elementa, ki je omenjen v (5). (13 točk)
Ena najpomembnejših kovin za metalurgijo je mangan. Poleg tega je na splošno precej nenavaden element, s katerim je povezan Zanimiva dejstva. Pomemben za žive organizme, nujen pri proizvodnji številnih zlitin, kemične snovi. Mangan - fotografija, ki jo lahko vidite spodaj. V tem članku bomo obravnavali njegove lastnosti in značilnosti.
Značilnosti kemijskega elementa
Če govorimo o manganu kot elementu, potem bi morali najprej opredeliti njegov položaj v njem.
- Nahaja se v četrtem glavnem obdobju, sedmi skupini, sekundarni podskupini.
- Serijska številka - 25. Mangan - kemični element, katerega atomi so +25. Število elektronov je enako, nevtronov - 30.
- Vrednost atomske mase je 54,938.
- Simbol kemijskega elementa za mangan je Mn.
- Latinsko ime je mangan.
Nahaja se med kromom in železom, kar pojasnjuje podobnost z njimi v fizikalnih in kemijskih lastnostih.
Mangan - kemični element: prehodna kovina
Če upoštevamo elektronsko konfiguracijo danega atoma, bo njegova formula videti takole: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5. Očitno postane, da je element, ki ga obravnavamo, iz družine d. Pet elektronov v 3d podravni označuje stabilnost atoma, ki se kaže v njegovih kemijskih lastnostih.
Kot kovina je mangan redukcijsko sredstvo, vendar ima večina njegovih spojin dokaj močne oksidacijske sposobnosti. To je posledica različnih oksidacijskih stanj in valenc, ki jih ima določen element. To je posebnost vseh kovin te družine.
Tako je mangan kemični element, ki se nahaja med drugimi atomi in ima svoje posebne značilnosti. Poglejmo si podrobneje, kaj so te lastnosti.

Mangan je kemični element. Oksidacijsko stanje
Podali smo že elektronsko formulo atoma. Glede na to je ta element sposoben pokazati več pozitivnih oksidacijskih stanj. to:
Valenca atoma je IV. Najbolj stabilne spojine so tiste, v katerih ima mangan vrednosti +2, +4, +6. Najvišja stopnja oksidacije omogoča, da spojine delujejo kot močni oksidanti. Na primer: KMnO 4, Mn 2 O 7.
Spojine z +2 so reducenti, manganov (II) hidroksid ima amfoterne lastnosti, pri čemer prevladujejo bazične. Vmesna oksidacijska stanja tvorijo amfoterne spojine.
Zgodovina odkritja
Mangan je kemični element, ki ga različni znanstveniki niso odkrili takoj, ampak postopoma. Vendar so ljudje njegove spojine uporabljali že od antičnih časov. Manganov(IV) oksid so uporabljali za izdelavo stekla. Neki Italijan je navedel dejstvo, da dodatek te spojine med kemično proizvodnjo očal obarva vijolično. Poleg tega ista snov pomaga odpraviti meglico v barvnih steklih.
Kasneje v Avstriji je znanstveniku Keimu uspelo pridobiti kos kovinskega mangana z izpostavitvijo purolizita (manganov (IV) oksid), pepelike in premoga visokim temperaturam. Vendar je imel ta vzorec veliko nečistoč, ki jih ni mogel odstraniti, zato do odkritja ni prišlo.
Še kasneje je drug znanstvenik prav tako sintetiziral mešanico, v kateri je bil znaten delež čista kovina. Bergman je bil tisti, ki je pred tem odkril element nikelj. Vendar mu ni bilo usojeno dokončati zadeve.

Mangan je kemični element, ki ga lahko pridobimo in izoliramo v obliki preprosta snov Karlu Scheeleju je to prvič uspelo leta 1774. Vendar je to storil skupaj z I. Ganom, ki je dokončal postopek taljenja kosa kovine. A niti njim ga ni uspelo popolnoma znebiti nečistoč in doseči 100-odstotnega izkoristka izdelka.
Kljub temu je bil ravno tokrat atom odkrit. Ti isti znanstveniki so ga poskušali imenovati kot odkritelji. Izbrali so izraz mangan. Po odkritju magnezija pa se je začela zmeda in ime mangan se je spremenilo v moderno ime (H. David, 1908).
Ker je mangan kemijski element, katerega lastnosti so zelo dragocene za številne metalurške procese, je bilo sčasoma treba najti način, kako ga pridobiti v najčistejši možni obliki. Ta problem so rešili znanstveniki po vsem svetu, vendar je bil rešen šele leta 1919 zahvaljujoč delu R. Agladzeja, sovjetskega kemika. Prav on je našel način za pridobivanje čiste kovine z vsebnostjo snovi 99,98% iz manganovih sulfatov in kloridov z elektrolizo. Zdaj se ta metoda uporablja po vsem svetu.
Biti v naravi
Mangan je kemični element, katerega fotografija preproste snovi je prikazana spodaj. V naravi je veliko izotopov tega atoma, število nevtronov v katerih se zelo razlikuje. Tako se masna števila gibljejo od 44 do 69. Edini stabilni izotop pa je element z vrednostjo 55 Mn, vsi ostali pa imajo bodisi zanemarljivo kratko razpolovno dobo bodisi obstajajo v premajhnih količinah.

Ker je mangan kemijski element, katerega stopnja oksidacije je zelo različna, tvori tudi v naravi številne spojine. Tega elementa nikoli ne najdemo v svoji čisti obliki. V mineralih in rudah je njegov stalni sosed železo. Skupaj lahko identificiramo nekaj najpomembnejših skale, ki vsebujejo mangan.
- piroluzit. Formula spojine: MnO 2 *nH 2 O.
- Psilomelan, molekula MnO2*mMnO*nH2O.
- Manganit, formula MnO*OH.
- Brownit je manj pogost kot drugi. Formula Mn 2 O 3.
- Hausmanit, formula Mn*Mn 2 O 4.
- Rodonit Mn 2 (SiO 3) 2.
- Manganove karbonatne rude.
- Škrlat ali rodokrozit - MnCO 3.
- Purpurit - Mn 3 PO 4.
Poleg tega je mogoče identificirati več mineralov, ki prav tako vsebujejo obravnavani element. to:
- kalcit;
- siderit;
- minerali gline;
- kalcedon;
- opal;
- spojine peska in mulja.
Mangan je poleg kamnin in sedimentnih kamnin, mineralov kemični element, ki je del naslednjih predmetov:
- Rastlinski organizmi. Največji rezervoarji tega elementa so: vodni kostanj, vodna leča in diatomeje.
- Rjaste gobe.
- Nekatere vrste bakterij.
- Naslednje živali: rdeče mravlje, raki, mehkužci.
- Ljudje - dnevna potreba je približno 3-5 mg.
- Vode Svetovnega oceana vsebujejo 0,3% tega elementa.
- Skupna vsebnost v zemeljski skorji je 0,1 mas.%.
Na splošno je to 14. najpogostejši element na našem planetu. Med težkimi kovinami je na drugem mestu za železom.
Fizične lastnosti
Z vidika lastnosti mangana kot preproste snovi je več glavnih telesne lastnosti zanj.
- V obliki preproste snovi je precej trda kovina (na Mohsovi lestvici je indikator 4). Barva je srebrno bela, na zraku se prekrije z zaščitno oksidno folijo, pri rezu pa se sveti.
- Tališče je 1246 0 C.
- Vrelišče - 2061 0 C.
- Prevodne lastnosti so dobre, je paramagneten.
- Gostota kovine je 7,44 g/cm 3 .
- Obstaja v obliki štirih polimorfnih modifikacij (α, β, γ, σ), ki se razlikujejo po strukturi in obliki kristalne mreže ter atomski gostoti pakiranja. Razlikujejo se tudi njihova tališča.
V metalurgiji se uporabljajo tri glavne oblike mangana: β, γ, σ. Alfa je manj pogosta, saj je po svojih lastnostih preveč krhka.

Kemijske lastnosti
S kemijskega vidika je mangan kemijski element, katerega ionski naboj se močno spreminja od +2 do +7. To pusti pečat na njegovi dejavnosti. V prosti obliki na zraku mangan zelo šibko reagira z vodo in se topi v razredčenih kislinah. Kakor hitro pa se temperatura poveča, se aktivnost kovine močno poveča.
Torej je sposoben interakcije z:
- dušik;
- ogljik;
- halogeni;
- silicij;
- fosfor;
- žveplo in druge nekovine.
Pri segrevanju brez dostopa zraka kovina zlahka preide v stanje pare. Glede na stopnjo oksidacije, ki jo ima mangan, so lahko njegove spojine redukcijske in oksidacijske snovi. Nekateri imajo amfoterne lastnosti. Tako so glavne značilne za spojine, v katerih je +2. Amfoterno - +4, kislo in močno oksidativno pa pri najvišji vrednosti +7.
Kljub dejstvu, da je mangan prehodna kovina, je kompleksnih spojin zanj malo. To je posledica hleva elektronska konfiguracija atom, ker njegov 3d podnivoj vsebuje 5 elektronov.
Metode pridobivanja
Obstajajo trije glavni načini industrijske proizvodnje mangana (kemični element). Ker se ime bere v latinščini, smo ga že označili kot manganum. Če ga prevedete v ruščino, bo "da, res pojasnjujem, razbarvam." Mangan svoje ime dolguje svojim lastnostim, znanim že od antičnih časov.
Vendar ga je bilo kljub njegovi priljubljenosti mogoče dobiti v čisti obliki za uporabo šele leta 1919. To se naredi z naslednjimi metodami.
- Elektroliza, izkoristek produkta je 99,98 %. Na ta način pridobivajo mangan v kemični industriji.
- Silikotermna ali redukcija s silicijem. pri ta metoda silicijev in manganov (IV) oksid se stapljata, kar povzroči nastanek čiste kovine. Izkoristek je približno 68%, saj se mangan poveže s silicijem in tvori silicid kot stranski produkt. Ta metoda se uporablja v metalurški industriji.
- Aluminotermična metoda - redukcija z uporabo aluminija. Prav tako ne daje prevelikega izkoristka proizvoda, nastaja mangan, onesnažen z nečistočami.
Proizvodnja te kovine je pomembna za številne procese, ki se izvajajo v metalurgiji. Že majhen dodatek mangana lahko močno vpliva na lastnosti zlitin. Dokazano je, da se v njem raztopi veliko kovin, ki zapolnijo njegovo kristalno mrežo.

Z pridobivanjem in proizvodnjo tega elementa Rusija je na prvem mestu na svetu. Ta postopek se izvaja tudi v državah, kot so:
- Kitajska.
- Kazahstan.
- Georgia.
- Ukrajina.
Industrijska uporaba
Mangan je kemični element, katerega uporaba je pomembna ne le v metalurgiji. temveč tudi na drugih področjih. Poleg kovine v čisti obliki so velikega pomena tudi različne spojine določenega atoma. Naj opišemo glavne.
- Obstaja več vrst zlitin, ki imajo zahvaljujoč manganu edinstvene lastnosti. Na primer, je tako močan in odporen proti obrabi, da se uporablja za taljenje delov za bagre, stroje za obdelavo kamna, drobilnike, kroglične mline in oklepne dele.
- Manganov dioksid je bistven oksidacijski element pri galvanizaciji; uporablja se pri izdelavi depolarizatorjev.
- Veliko manganovih spojin je potrebnih za izvedbo organskih sintez različnih snovi.
- Kalijev permanganat (ali kalijev permanganat) se v medicini uporablja kot močno razkužilo.
- Ta element je del brona, medenine in tvori lastno zlitino z bakrom, ki se uporablja za izdelavo letalskih turbin, lopatic in drugih delov.
Biološka vloga
Dnevna potreba po manganu za ljudi je 3-5 mg. Pomanjkanje tega elementa vodi v depresijo živčni sistem, motnje spanja in tesnoba, omotica. Njegova vloga še ni v celoti raziskana, vendar je jasno, da najprej vpliva na:
- višina;
- aktivnost spolnih žlez;
- delo hormonov;
- tvorba krvi.
Ta element je prisoten v vseh rastlinah, živalih in ljudeh, kar dokazuje njegovo pomembno biološko vlogo.

Mangan je kemični element, zanimiva dejstva o katerem lahko navdušijo vsakogar in mu dajo vedeti, kako pomemben je. Predstavimo najosnovnejše od njih, ki so našle svoj pečat v zgodovini te kovine.
- V težkih časih državljanska vojna v ZSSR je bil eden prvih izvoznih izdelkov, ki vsebujejo rudo veliko število mangan
- Če manganov dioksid stopimo s solino in nato produkt raztopimo v vodi, se bodo začele neverjetne transformacije. Najprej bo raztopina postala zelena, nato se bo barva spremenila v modro in nato vijolično. Nazadnje se bo obarvalo škrlatno in postopoma bo nastala rjava oborina. Če mešanico pretresete, se bo spet povrnila zelena barva in vse se bo ponovilo. Zaradi tega je kalijev permanganat dobil ime, kar v prevodu pomeni "mineralni kameleon".
- Če v tla dodamo gnojila, ki vsebujejo mangan, se poveča produktivnost rastlin in stopnja fotosinteze. Ozimna pšenica bo bolje oblikovala zrnje.
- Največji blok manganovega minerala rodonita je tehtal 47 ton in je bil najden na Uralu.
- Obstaja trojna zlitina, imenovana manganin. Sestavljen je iz elementov, kot so baker, mangan in nikelj. Njegova edinstvenost je v tem, da ima visoko električno upornost, ki ni odvisna od temperature, ampak nanjo vpliva pritisk.
Seveda to ni vse, kar lahko rečemo o tej kovini. Mangan je kemični element, zanimiva dejstva o katerem so precej raznolika. Še posebej, če govorimo o lastnostih, ki jih daje različnim zlitinam.
Kemija kovin
Predavanje 2. Glavna vprašanja, obravnavana na predavanju
Kovine VIIB-podskupine
Splošne značilnosti kovin podskupine VIIB.
Kemija mangana
Naravne spojine Mn
Fizično in Kemijske lastnosti kovina
Mn spojine. Redoks lastnosti spojin
Kratke značilnosti Tc in Re.
Izvajalec: | Dogodek št. | ||||||||||||||||

Kovine VIIB-podskupine
splošne značilnosti
Podskupino VIIB tvorijo d-elementi: Mn, Tc, Re, Bh. |
|||||||||||
Valenčni elektroni so opisani s splošno formulo: |
|||||||||||
(n–1)d 5 ns2 | |||||||||||
Preproste snovi - kovine, srebrno siva, |
|||||||||||
mangan | |||||||||||
težka, z visokimi tališči, ki |
|||||||||||
povečajo pri prehodu iz Mn v Re, tako da glede na tesn |
|||||||||||
Taljivost Re je na drugem mestu za W. |
|||||||||||
Največji praktični pomen ima Mn. |
|||||||||||
tehnecij | Elementi Tc, Bh – radioaktivni elementi, umetni |
||||||||||
neposredno pridobljen kot rezultat jedrske fuzije; ponovno |
|||||||||||
redek element. | |||||||||||
Elementa Tc in Re sta si bolj podobna kot |
|||||||||||
z manganom. Tc in Re imata bolj stabilno višjo |
|||||||||||
oksidacija, zato imajo ti elementi a |
|||||||||||
Spojine v oksidacijskem stanju 7 so čudne. |
|||||||||||
Za Mn so značilna oksidacijska stanja: 2, 3, 4, |
|||||||||||
Bolj stabilen - | 2 in 4. Ta oksidacijska stanja |
||||||||||
pojavljajo v naravnih spojinah. Najpogostejši
čudni Mn minerali: piroluzit MnO2 in rodokrozit MnCO3.
Mn(+7) in (+6) spojine so močni oksidanti.
Mn, Tc, Re kažejo največjo podobnost pri visokooksidativnih
lacija, se izraža v kislosti višjih oksidov in hidroksidov.
Izvajalec: | Dogodek št. | ||||||||||||||||
Močni so višji hidroksidi vseh elementov podskupine VIIB
kisline s splošno formulo NEO4.
V najvišji oksidacijski stopnji so elementi Mn, Tc in Re podobni elementu glavne podskupine kloru. Kisline: HMnO4, HTcO4, HReO4 in
HClO4 so močni. Za elemente VIIB-podskupine je značilna opazna
pomembna podobnost s svojimi sosedi v seriji, zlasti Mn kaže podobnost z Fe. V naravi so spojine Mn vedno v bližini spojin Fe.
Margan
Značilna oksidacijska stanja
Valenčni elektroni Mn – 3d5 4s2. |
|||
Najpogostejše diplome |
|||
3d5 4s2 | mangan | oksidacijske vrednosti za Mn so 2, 3, 4, 6, 7; |
|
bolj stabilen - 2 in 4. V vodnih raztopinah |
|||
oksidacijsko stanje +2 je stabilno v kislem in +4 – v |
|||
nevtralno, rahlo alkalno in rahlo kislo okolje.
Mn(+7) in (+6) spojine kažejo močne oksidativne lastnosti.
Kislinsko-bazični značaj Mn oksidov in hidroksidov je naravno posledica
variira glede na oksidacijsko stopnjo: v oksidacijskem stanju +2 sta oksid in hidroksid bazična, v najvišji oksidacijski stopnji pa kisla,
Poleg tega je HMnO4 močna kislina.
V vodnih raztopinah obstaja Mn(+2) v obliki akvacij
2+, ki ga zaradi enostavnosti označimo z Mn2+. Mangan v visokih oksidacijskih stopnjah je v raztopini v obliki tetraoksoanionov: MnO4 2– in
MnO4 – .
Izvajalec: | Dogodek št. | ||||||||||||||||

Naravne spojine in proizvodnja kovin
Element Mn po številčnosti v zemeljski skorji med težkimi kovinami
ribolov sledi železu, vendar je opazno slabši od njega - vsebnost Fe je približno 5%, Mn pa le približno 0,1%. Mangan ima pogostejši oksid-
ny in karbonat ter rude. Najpomembnejši minerali so: pirolitični
mesto MnO2 in rodokrozit MnCO3.
pridobiti Mn
Poleg teh mineralov se za pridobivanje Mn uporablja hausmanit Mn3 O4
in hidratirani psilomelanski oksid MnO2. xH2 O. V manganovih rudah vse
Mangan se uporablja predvsem pri proizvodnji posebnih vrst jekla, ki imajo visoko trdnost in odpornost na udarce. zato
nova količina Mn se ne pridobi v čisti obliki, ampak v obliki feromangana
tsa - zlitina mangana in železa, ki vsebuje od 70 do 88% Mn.
Skupni obseg letne svetovne proizvodnje mangana, vključno v obliki feromangana, je ~ (10 12) milijonov ton/leto.
Za pridobivanje feromangana se reducira ruda manganovega oksida
kurijo premog.
MnO2 + 2C = Mn + 2CO
Izvajalec: | Dogodek št. | ||||||||||||||||

Skupaj z Mn oksidi se reducirajo tudi Fe oksidi v rudi.
de. Za pridobivanje spojin mangana z minimalno vsebnostjo Fe in C
Fe predhodno ločimo in dobimo mešani oksid Mn3O4
(MnO . Mn2 O3 ). Nato se reducira z aluminijem (piroluzit reagira z
Al preveč nevihtno).
3Mn3 O4 + 8Al = 9Mn + 4Al2 O3
Čisti mangan se pridobiva s hidrometalurško metodo. Po predhodnem pridobivanju soli MnSO4 preko raztopine Mn sulfata,
električni tok, mangan se zmanjša na katodi:
Mn2+ + 2e– = Mn0.
Preprosta snov
Mangan je svetlo siva kovina. Gostota – 7,4 g/cm3. Tališče – 1245O C.
To je dokaj aktivna kovina E (Mn | / Mn) = - 1,18 V. |
||
V razredčenem stanju zlahka oksidira do kationa Mn2+ |
|||
kisline. | |||
Mn + 2H+ = Mn2+ + H2 |
|||
Mangan se pasivira v zgoščen |
|||
dušikove in žveplove kisline, pri segrevanju pa |
|||
riž. Mangan – se- | začne z njimi počasi komunicirati, a |
||
rdeča kovina, podobno | tudi pod vplivom tako močnih oksidantov |
||
za strojno opremo |
|||
Mn gre v kation |
|||
Mn2+. Pri segrevanju mangan v prahu reagira z vodo
sproščanje H2.
Zaradi oksidacije na zraku se mangan prekrije z rjavimi lisami,
V atmosferi kisika mangan tvori oksid |
||||||||||||||||||
Mn2 O3, pri višjih temperaturah pa mešani oksid MnO. Mn2 O3 |
||||||||||||||||||
(Mn3O4). | ||||||||||||||||||
Izvajalec: | Dogodek št. | |||||||||||||||||

Pri segrevanju mangan reagira s halogeni in žveplom. Mn afiniteta
do žvepla več kot železa, zato pri dodajanju feromangana jeklu,
v njem raztopljeno žveplo se veže na MnS. MnS sulfid se ne raztopi v kovini in gre v žlindro. Trdnost jekla se poveča po odstranitvi žvepla, ki povzroča krhkost.
Pri zelo visoke temperature(>1200 0 C) mangan v interakciji z dušikom in ogljikom tvori nestehiometrične nitride in karbide.
Manganove spojine
Manganove spojine (+7)
Vse spojine Mn(+7) kažejo močne oksidativne lastnosti.
Kalijev permanganat KMnO 4 – najpogostejša povezava
Mn(+7). V svoji čisti obliki je ta kristalna snov temna
vijolična barva. Ko se kristalni permanganat segreje, se razgradi
2KMnO4 = K2 MnO4 + MnO2 + O2 |
||
Iz te reakcije v laboratoriju lahko dobite |
||
MnO4 anion – barvne trajne raztopine |
||
ganata v malinasto vijolični barvi. Na |
||
površine v stiku z raztopino |
||
riž. Raztopina KMnO4 roza- | KMnO4, zaradi sposobnosti permanganata, da oksidira |
|
vijolična barva | prelijemo z vodo, tanko rumeno-rjavo |
|
MnO2 oksidni filmi. |
||
4KMnO4 + 2H2 O = 4MnO2 + 3O2 + 4KOH |
||
Za upočasnitev te reakcije, ki se pospeši na svetlobi, se shranijo raztopine KMnO4
nyat v temnih steklenicah.
Pri dodajanju nekaj kapljic zgoščenega
trilirana žveplova kislina proizvaja permanganov anhidrid.
Izvajalec: | Dogodek št. | ||||||||||||||||
2KMnO4 + H2 SO4 2Mn2 O7 + K2 SO4 + H2 O
Mn 2 O 7 oksid je težka oljnata tekočina temno zelene barve. To je edini kovinski oksid, ki je v normalnih pogojih
Je v tekočem stanju (tališče 5,9 0 C). Oksid ima molekularno
kularna struktura, zelo nestabilna, eksplozivno razpade pri 55 0 C. 2Mn2 O7 = 4MnO2 + 3O2
Mn2O7 oksid je zelo močan in energičen oksidant. Veliko oz.
ganske snovi pod njegovim vplivom oksidirajo v CO2 in H2 O. Oksid
Mn2 O7 včasih imenujemo kemične vžigalice. Če stekleno paličico navlažimo v Mn2O7 in prinesemo k alkoholni svetilki, bo zasvetila.
Ko se Mn2O7 raztopi v vodi, nastane permanganska kislina.
Kislina HMnO 4 je močna kislina, obstaja samo v vodni
nomska raztopina, ki ni izolirana v prostem stanju. Kislina HMnO4 razgradi-
s sproščanjem O2 in MnO2.
Pri dodajanju trdne alkalije raztopini KMnO4 se nastanek
nastanek zelenega manganata.
4KMnO4 + 4KOH (k) = 4K2 MnO4 + O2 + 2H2 O.
Pri segrevanju KMnO4 s koncentrirano klorovodikovo kislino nastane
Prisoten je plin Cl2.
2KMnO4 (k) + 16HCl (konc.) = 2MnCl2 + 5Cl2 + 8H2 O + 2KCl
Te reakcije razkrivajo močne oksidativne lastnosti permanganata.
Produkti interakcije KMnO4 z reducenti so odvisni od kislosti raztopine v katerem poteka reakcija.
V kislih raztopinah nastane brezbarven kation Mn2+.
MnO4 – + 8H+ +5e– Mn2+ + 4H2 O; (E0 = +1,53 V).
Iz nevtralnih raztopin se izloča rjava oborina MnO2.
MnO4 – +2H2 O +3e– MnO2 + 4OH– .
V alkalnih raztopinah nastane zeleni anion MnO4 2–.
Izvajalec: | Dogodek št. | ||||||||||||||||

Kalijev permanganat se v industriji pridobiva bodisi iz mangana
(oksidiramo ga na anodi v alkalni raztopini) ali iz piroluzita (MnO2 je pred-
pri vrenju oksidira v K2 MnO4, ki se nato na anodi oksidira v KMnO4).
Manganove spojine (+6)
Manganati so soli z anionom MnO4 2– in so svetlo zelene barve.
Anion MnO4 2─ je stabilen le v močno alkalnem okolju. Pod vplivom vode in zlasti kisline se manganati nesorazmerno porazdelijo v spojino
Mn v oksidacijskih stanjih 4 in 7.
3MnO4 2– + 2H2 O= MnO2 + 2MnO4 – + 4OH–
Iz tega razloga kislina H2 MnO4 ne obstaja.
Manganate lahko dobimo s taljenjem MnO2 z alkalijami ali karbonatom
mi v prisotnosti oksidanta.
2MnO2 (k) + 4KOH (l) + O2 = 2K2 MnO4 + 2H2 O
Manganati so močni oksidanti , če pa so prizadeti
Če uporabimo še močnejši oksidant, se spremenijo v permanganate.
Nesorazmernost
Manganove spojine (+4)
– najstabilnejša spojina Mn. Ta oksid se pojavlja naravno (mineral piroluzit).
MnO2 oksid je črno-rjava snov z zelo močnim kristalom
ična mreža (enako kot rutilni TiO2). Zaradi tega kljub dejstvu, da MnO 2 oksid je amfoteren, ne reagira z raztopinami alkalij in z razredčenimi kislinami (tako kot TiO2). Topi se v koncentriranih kislinah.
MnO2 + 4HCl (konc.) = MnCl2 + Cl2 + 2H2 O
Reakcija se uporablja v laboratoriju za proizvodnjo Cl2.
Pri raztapljanju MnO2 v koncentrirani žveplovi in dušikovi kislini nastaneta Mn2+ in O2.
Tako se MnO2 v zelo kislem okolju rad spremeni v
Mn2+ kation.
MnO2 reagira z alkalijami le v talinah s tvorbo mešanice
oksidi. V prisotnosti oksidanta se v alkalnih talinah tvorijo manganati.
MnO2 oksid se uporablja v industriji kot poceni oksidant. Še posebej, redoks interakcija
Izvajalec: | 2 razpade s sproščanjem O2 in nastankom |
Izvajalec: | Dogodek št. | ||||||||||||||||
Dolgo časa je ena od spojin tega elementa, in sicer njegov dioksid (znan kot piroluzit), veljala za vrsto mineralne magnetne železove rude. Šele leta 1774 je eden od švedskih kemikov odkril, da piroluzit vsebuje neraziskano kovino. Zaradi segrevanja tega minerala s premogom je bilo mogoče dobiti isto neznano kovino. Sprva so ga imenovali mangan, kasneje se je pojavilo sodobno ime - mangan. Kemični element ima veliko zanimivih lastnosti, o katerih bomo razpravljali spodaj.
Nahaja se v stranski podskupini sedme skupine periodni sistem(pomembno: vsi elementi stranskih podskupin so kovine). Elektronska formula 1s2 2s2 2p6 3s2 3p6 4s2 3d5 (tipična formula d-elementa). Mangan kot prosta snov ima srebrno belo barvo. Zaradi svoje kemične aktivnosti se v naravi pojavlja le v obliki spojin, kot so oksidi, fosfati in karbonati. Snov je ognjevzdržna, tališče je 1244 stopinj Celzija.
zanimivo! V naravi najdemo samo en izotop kemičnega elementa z atomsko maso 55. Preostale izotope pridobivamo umetno, najstabilnejši radioaktivni izotop pa ima atomsko maso 53 (razpolovna doba je približno enaka razpolovni dobi urana). ).
Oksidacijsko stanje mangana
Ima šest različnih oksidacijskih stanj. V ničelnem oksidacijskem stanju je element sposoben tvoriti kompleksne spojine z organskimi ligandi (na primer P(C5H5)3), pa tudi z anorganskimi ligandi:
- ogljikov monoksid (dimanganov dekakarbonil),
- dušik,
- fosforjev trifluorid,
- dušikov oksid.
Oksidacijsko stanje +2 je značilno za manganove soli. Pomembno: te spojine imajo izključno obnovitvene lastnosti. Najbolj stabilne spojine z oksidacijskim stanjem +3 so oksid Mn2O3, pa tudi hidrat tega oksida Mn(OH)3. Pri +4 sta najbolj stabilna MnO2 in amfoterni oksid-hidroksid MnO(OH)2.
Oksidacijsko stanje mangana +6 je značilno za manganovo kislino in njene soli, ki obstajajo samo v vodni raztopini. Oksidacijsko stanje +7 je značilno za permanganovo kislino, njen anhidrid in soli - permanganate (analogno perkloratom) - močne oksidante, ki obstajajo samo v vodni raztopini. Zanimivo je, da so pri redukciji kalijevega permanganata (v vsakdanjem življenju imenovanega kalijev permanganat) možne tri različne reakcije:
- V prisotnosti žveplove kisline se anion MnO4- reducira v Mn2+.
- Če je medij nevtralen, se ion MnO4- reducira v MnO(OH)2 ali MnO2.
- V prisotnosti alkalije se anion MnO4- reducira v manganatni ion MnO42-.

Mangan kot kemijski element
Kemijske lastnosti
V normalnih pogojih je neaktiven. Razlog je oksidni film, ki se pojavi, ko je izpostavljen atmosferskemu kisiku. Če kovinski prah rahlo segrejemo, zgori in se spremeni v MnO2.
Pri segrevanju medsebojno deluje z vodo in izpodriva vodik. Kot rezultat reakcije dobimo praktično netopen hidroksid Mn(OH)2. Ta snov preprečuje nadaljnjo interakcijo z vodo.
zanimivo! Vodik je topen v manganu, z naraščanjem temperature pa se topnost povečuje (dobimo raztopino plina v kovini).
Pri zelo močnem segrevanju (temperature nad 1200 stopinj Celzija) reagira z dušikom, pri čemer nastanejo nitridi. Te spojine imajo lahko različne sestave, kar je značilno za tako imenovane bertolide. Medsebojno deluje z borom, fosforjem, silicijem in v staljeni obliki - z ogljikom. Zadnja reakcija poteka med redukcijo mangana s koksom.
Pri reakciji z razredčeno žveplovo in klorovodikovo kislino nastane sol in sprošča vodik. Toda interakcija z močno žveplovo kislino je drugačna: produkti reakcije so sol, voda in žveplov dioksid (sprva žveplova kislina reducira se v žveplo; vendar zaradi nestabilnosti žveplova kislina razpade na žveplov dioksid in vodo).
Pri reakciji z razredčeno dušikovo kislino nastanejo nitrat, voda in dušikov oksid.
Tvori šest oksidov:
- dušikov oksid ali MnO,
- oksid ali Mn2O3,
- oksid-oksid Mn3O4,
- dioksid ali MnO2,
- manganov anhidrid MnO3,
- manganov anhidrid Mn2O7.
zanimivo! Pod vplivom atmosferskega kisika se dušikov oksid postopoma spremeni v oksid. Anhidrid permanganata ni bil izoliran v prosti obliki.
Oksid je spojina s tako imenovanim frakcijskim oksidacijskim stanjem. Pri raztapljanju v kislinah nastanejo soli dvovalentnega mangana (soli s kationom Mn3+ so nestabilne in se reducirajo v spojine s kationom Mn2+).
Dioksid, oksid, dušikov oksid so najbolj stabilni oksidi. Manganov anhidrid je nestabilen. Obstajajo analogije z drugimi kemičnimi elementi:
- Mn2O3 in Mn3O4 sta bazična oksida in njune lastnosti so podobne podobnim železovim spojinam;
- MnO2 je amfoteren oksid, po lastnostih podoben aluminijevim in trivalentnim kromovim oksidom;
- Mn2O7 - kislinski oksid, njegove lastnosti so zelo podobne višjemu klorovemu oksidu.
Zlahka je opaziti analogijo s klorati in perklorati. Manganate, tako kot klorate, pridobivamo posredno. Toda permanganate lahko pridobimo neposredno, to je z interakcijo anhidrida in kovinskega oksida/hidroksida v prisotnosti vode, ali posredno.
V analizni kemiji sodi kation Mn2+ v peto analizno skupino. Obstaja več reakcij, ki lahko zaznajo ta kation:
- Pri interakciji z amonijevim sulfidom nastane oborina MnS, njena barva je mesnate barve; Ko dodamo mineralne kisline, se oborina raztopi.
- Pri reakciji z alkalijami dobimo belo oborino Mn(OH)2; pri interakciji z atmosferskim kisikom pa se barva oborine spremeni iz bele v rjavo - dobimo Mn(OH)3.
- Če soli s kationom Mn2+ dodamo vodikov peroksid in raztopino alkalije, se izloči temno rjava oborina MnO(OH)2.
- Ko soli s kationom Mn2+ dodamo oksidant (svinčev dioksid, natrijev bizmutat) in močno raztopino dušikove kisline, se raztopina obarva škrlatno – to pomeni, da je Mn2+ oksidiral v HMnO4.

Kemijske lastnosti
Valenca mangana
Element je v sedmi skupini. Tipični mangan - II, III, IV, VI, VII.
Ničelna valenca je značilna za prosto snov. Dvovalentne spojine so soli s kationom Mn2+, trivalentne spojine so oksid in hidroksid, štirivalentne spojine so dioksid, pa tudi oksid-hidroksid. Heksa- in sedemvalentne spojine so soli z anioni MnO42- in MnO4-.
Kako pridobiti in iz česa se pridobiva mangan? Iz manganove in feromanganove rude, pa tudi iz raztopin soli. Znani so trije različne poti pridobivanje mangana:
- okrevanje s kokakolo,
- aluminotermija,
- elektroliza.
V prvem primeru se kot reducent uporabljata koks in ogljikov monoksid. Kovina se pridobi iz rude, ki vsebuje primesi železovih oksidov. Rezultat sta tako feromangan (zlitina z železom) kot karbid (kaj je karbid? je spojina kovine in ogljika).
Za pridobitev čistejše snovi se uporablja ena od metod metalotermije - aluminotermija. Najprej se piroluzit kalcinira, pri čemer nastane Mn2O3. Nastali oksid nato zmešamo z aluminijevim prahom. Med reakcijo se sprosti veliko toplote, zaradi česar se nastala kovina stopi, aluminijev oksid pa jo pokrije s "kapo" iz žlindre.
Mangan je kovina srednje aktivnosti in stoji v Beketovem nizu levo od vodika in desno od aluminija. To pomeni, da pri elektrolizi vodnih raztopin soli s kationom Mn2+ pride do redukcije kovinskega kationa na katodi (pri elektrolizi zelo razredčene raztopine se na katodi reducira tudi voda). Pri elektrolizi vodne raztopine MnCl2 pride do naslednjih reakcij:
MnCl2 Mn2+ + 2Cl-
Katoda (negativno nabita elektroda): Mn2+ + 2e Mn0
Anoda (pozitivno nabita elektroda): 2Cl- - 2e 2Cl0 Cl2
Končna reakcijska enačba je:
MnCl2 (el-z) Mn + Cl2
Z elektrolizo dobimo najčistejšo kovino mangan.
Koristen video: mangan in njegove spojine
Aplikacija
Uporaba mangana je precej široka. Uporabljajo se tako sama kovina kot njene različne spojine. V prosti obliki se uporablja v metalurgiji za različne namene:
- kot "deoksidant" pri taljenju jekla (kisik se veže in nastane Mn2O3);
- kot legirni element: proizvaja močno jeklo z visoko odpornostjo proti obrabi in udarcem;
- za taljenje tako imenovanega oklepnega jekla;
- kot sestavni del brona in medenine;
- za ustvarjanje manganina, zlitine bakra in niklja. Iz te zlitine so izdelane različne električne naprave, na primer reostati
MnO2 se uporablja za izdelavo Zn-Mn galvanskih členov. MnTe in MnAs se uporabljata v elektrotehniki.

Uporaba mangana
Kalijev permanganat, pogosto imenovan kalijev permanganat, se pogosto uporablja tako v vsakdanjem življenju (za zdravilne kopeli) kot v industriji in laboratorijih. Škrlatna barva permanganata se razbarva, ko skozi raztopino prehajajo nenasičeni ogljikovodiki z dvojnimi in trojnimi vezmi. Pri močnem segrevanju se permanganati razgradijo. Pri tem nastajajo manganati, MnO2 in kisik. To je eden od načinov pridobivanja kemično čistega kisika v laboratorijskih pogojih.
Soli permanganatne kisline je mogoče dobiti le posredno. Da bi to naredili, se MnO2 zmeša s trdno alkalijo in segreje v prisotnosti kisika. Drug način za pridobivanje trdnih manganatov je žganje permanganatov.
Raztopine manganatov imajo lepo temno zeleno barvo. Vendar pa so te raztopine nestabilne in so podvržene reakciji disproporcioniranja: temno zelena barva se spremeni v škrlatno, nastane pa tudi rjava oborina. Rezultat reakcije je permanganat in MnO2.
Manganov dioksid se v laboratoriju uporablja kot katalizator za razgradnjo kalijevega klorata (Bertholletova sol), pa tudi za proizvodnjo čistega klora. Zanimivo je, da kot posledica interakcije MnO2 s klorovodikom dobimo vmesni produkt - izjemno nestabilno spojino MnCl4, ki razpade na MnCl2 in klor. Nevtralne ali nakisane raztopine soli s kationom Mn2+ so bledo rožnate barve (Mn2+ tvori kompleks s 6 molekulami vode).
Koristen video: mangan - element življenja
Zaključek
To je kratek opis mangan in njegove kemijske lastnosti. Je srebrno bela kovina srednje aktivnosti, z vodo komunicira le pri segrevanju in glede na stopnjo oksidacije kaže tako kovinske kot nekovinske lastnosti. Njegove spojine se uporabljajo v industriji, doma in v laboratorijih za proizvodnjo čistega kisika in klora.